哈尔滨师范大学附属中学高一化学上册期末考试刷题练习
| 1. 选择题 | 详细信息 |
|
下列常用危险化学药品与对应的分类正确的是( ) ①酒精——剧毒品 ②浓硫酸——腐蚀品 ③汽油——易燃品 ④液氯——放射性物品 ⑤高锰酸钾——氧化剂 ⑥黑火药——爆炸品 A.②③④⑥ B.①②⑤ C.①④⑤ D.②③⑤⑥ |
|
| 2. 选择题 | 详细信息 | ||||||||
化学为人类的进步做出了巨大贡献。下列过程中,不涉及化学反应的是( )
|
|||||||||
| 3. 选择题 | 详细信息 |
|
实验室中需要配制0.2 mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称量的NaCl的质量分别是( ) A.1000 mL,l1.7g B.950mL,11.1 g C.500mL,11.7g D.100mL,11.7g |
|
| 4. 选择题 | 详细信息 |
|
下列试剂保存方法错误的是 A. 钠应保存在石蜡油或煤油中 B. 氢氟酸保存在玻璃瓶中 C. 保存FeSO4溶液时加入少量的铁粉 D. Na2CO3溶液保存在带橡皮塞的玻璃瓶中 |
|
| 5. 选择题 | 详细信息 |
|
下列说法正确的是( ) A.Cl2、ClO2、O3、明矾均可用于自来水的杀菌、消毒 B.可以用澄清石灰水鉴别小苏打溶液与苏打溶液 C.制普通玻璃的主要原料为纯碱、石灰石和石英砂 D.工业冶炼粗硅的原理: SiO2+C |
|
| 6. 选择题 | 详细信息 |
|
下列离子方程式不正确的是( ) A.用硝酸银溶液检验自来水中的氯离子:Ag++Cl-=AgCl↓ B.Al2O3溶于NaOH 溶液: Al2O3 + 2OH-= 2AlO2-+ H2O C.NaOH 溶液不能保存在玻璃塞的试剂瓶中:SiO2+ 2OH-= SiO32-+ H2O D.NaHCO3 溶液与少量的澄清石灰水反应:HCO3-+ Ca2++OH-=CaCO3↓+H2O |
|
| 7. 选择题 | 详细信息 |
|
下列物质分类正确的是( ) A.Na2O2、Fe2O3、Al2O3均为碱性氧化物 B.稀豆浆、硅酸溶胶、CuSO4溶液均为胶体 C.烧碱、冰醋酸、四氯化碳均为电解质 D.盐酸、水玻璃、漂白液均为混合物 |
|
| 8. 选择题 | 详细信息 |
|
下列实验装置可用于分离互不相溶的两种液体的是 A.  B. B.  C. C. |
|
| 9. 选择题 | 详细信息 |
|
下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是( ) A.MnO4-,K+,Na+,NO3- B.Na+,K+,HCO3-,Cl- C.Ba2+,K+,S2-,SO42- D.Na+,NH4+,Cl-,SO42- |
|
| 10. 选择题 | 详细信息 |
|
下列有关铁及其化合物的说法正确的是( ) A.铁的氧化物有FeO、Fe2O3、Fe3O4,它们都是黑色的固体 B.FeO不稳定,在空气里受热,迅速被氧化成Fe3O4 C.鉴别Fe2+中混有Fe3+,可先加入氯水,再加入KSCN溶液 D.生铁比纯铁硬度大,熔点高 |
|
| 11. 选择题 | 详细信息 |
|
下列叙述正确的是( ) ①氯气是黄绿色的有毒气体 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 ③新制氯水因含有Cl2而呈黄绿色或浅黄绿色,有强的氧化性 ④检验HCl气体中是否混有Cl2的方法是将气体通过湿润的KI淀粉试纸 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水 A.①②③④ B.②③ C.①③ D.①②③④⑤ |
|
| 12. 选择题 | 详细信息 |
|
用光洁的铂丝蘸取无色溶液在无色灯焰上灼烧时观察到黄色火焰,下列叙述正确的是( ) A.只含有Na+ B.一定含Na+,也可含K+ C.既含Na+又含有K+ D.可能含Na+或K+中一种 |
|
| 13. 选择题 | 详细信息 |
|
下列有关实验现象与物质性质对应关系的说法中,错误的是( ) A.Cl2使湿润的有色布条褪色,说明Cl2具有漂白性 B.Na2CO3溶液遇酚酞变红,说明Na2CO3溶液呈碱性 C.Al(OH)3悬浊液既能溶于强酸又能溶于强碱,说明Al(OH)3具有两性 D.新制的Fe(OH)2悬浊液遇氧气变为红褐色,说明Fe(OH)2具有还原性 |
|
| 14. 选择题 | 详细信息 |
|
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应: Al2O3+N2+3C A.Al2O3的摩尔质量为102g B.AlN中氮的化合价为+3 C.CO为氧化产物 D.反应中N2是还原剂 |
|
| 15. 选择题 | 详细信息 | |||||||||||||||
下列“实验结论”与“实验操作及现象”相符的一组是
|
||||||||||||||||
| 16. 选择题 | 详细信息 |
下列各组物质的转化中,一定条件下均能一步实现的组合是( ) A.①②④ B.①②③ C.②③④ D.①②③④ |
|
| 17. 选择题 | 详细信息 |
|
设NA表示阿伏加德罗常数的值,下列说法正确的是( ) A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA B.常温常压下,100 g质量分数为17% 的H2O2溶液中含氧原子数目为NA C.4.4gCO2与足量Na2O2反应转移电子数为0.1NA D.标况下,4.48L的水中含有H2O分子的数目为0.2NA |
|
| 18. 选择题 | 详细信息 |
在FeCl3和CuCl2的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示。则该溶液中FeCl3与CuCl2的物质的量浓度之比为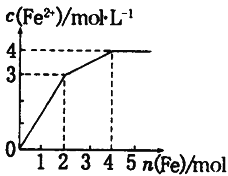 A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1 |
|
| 19. 选择题 | 详细信息 |
|
液体铝钠合金(钠和铝熔合而成)可用于核反应堆的载热介质。下列有关说法不正确的是( ) A.自然界中没有游离的钠和铝 B.若铝钠合金投入水中无固体剩余,则n(Al)≤n(Na) C.铝钠合金投入到氯化铜溶液中,一定有氢氧化铜沉淀,也可能有铜析出 D.相同质量不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则铝的质量分数越小 |
|
| 20. 选择题 | 详细信息 |
|
将NaAlO2溶液和稀盐酸等体积混合,得到的沉淀物中含铝元素的质量与溶液中铝元素的质量相等,则原NaAlO2溶液和稀盐酸的物质的量浓度之比可能是( ) A.1∶1 B.2∶3 C.1∶4 D.2∶5 |
|
| 21. 选择题 | 详细信息 |
|
将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( ) A.等于0.6mol B.小于0.6mol C.大于0.6mol,小于1.2mol D.等于1.2mol |
|
| 22. 选择题 | 详细信息 |
向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示(不考虑CO2的溶解)。下列判断正确的是 A.原NaOH溶液的浓度为0.2 mol/L B.通入CO2在的体积为336 mL C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3 D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)=1∶1 |
|
| 23. 选择题 | 详细信息 |
|
将Mg、Al组成的mg混合物投入一定量稀HCl中,固体完全溶解,收集到气体为1.12L(标准状况),向反应后溶液中加入2 mol/L NaOH溶液60mL时,金属离子恰好沉淀完全,则形成沉淀的质量为( ) A.(m+1.7)g B.(m+2.04)g C.(m+3.4)g D.(m+4.08)g |
|
| 24. 选择题 | 详细信息 |
|
在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,BrF3中溴的化合价为+3,若有0.5mol H2O参加反应,则被水还原的BrF3的物质的量是( ) A. |
|
| 25. 综合题 | 详细信息 | ||||||||||
|
I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号); 物质 描述 A.四氧化三铁 a.自来水消毒剂 B.过氧化钠 b.工业制玻璃 C.碳酸氢钠 c.红色油漆和涂料 D.硅酸钠 d.木材防火剂 E.明矾 e.呼吸面具中氧气的来源 F.青铜 f.制光纤的材料 G.硅 g.用量最大的金属材料 H.氯气 h.焰色反应为绿色 II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________; (3)漂白粉溶液中通过量CO2的离子方程式________________; (4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol; (5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______ SO32- + MnO4- + — SO42-+ Mn2+ +______ III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
|
|||||||||||
| 26. 推断题 | 详细信息 |
下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。①是实验室制取丁的反应之一。各物质间的转化如下图所示,回答下列问题(部分生成物未列出): (1)物质I的化学式为________; (2)在反应①中,当生成标准状况下丁气体4.48L时,反应转移的电子数约为___________; (3)B与K的反应是实验室制取丙的反应,其离子方程式为________________; (4)反应②的化学方程式为_____________; (5)若E与G以物质的量比为1:1投入足量水中,反应的离子方程式为________; (6)写出实验室检验F中阴离子的方法_____________。 |
|
| 27. 实验题 | 详细信息 |
某课外活动小组设计了下列装置,验证二氧化碳跟过氧化钠反应时需要与水接触。 (装置分析) (1)装置①中反应的离子方程式是___________; (2)装置②中的试剂是______(填字母),装置③中的试剂是_________(填字母); a 饱和NaHCO3溶液 b 饱和Na2CO3溶液 c 浓H2SO4 d NaOH溶液 (进行实验) 步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。 步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。 (3)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是 步骤1中_____________,步骤2中_____________; (4)步骤2中过氧化钠跟二氧化碳反应的化学方程式是_______________; (实验反思) (5)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应” 。其理由是____________; (6)需要补充的实验操作是:取⑤中反应后的少量固体,______________; (测定实验)测定反应后⑤中固体CO32-的质量分数 (7)将反应后⑤中固体,称量质量为ag。将ag固体溶于水,加入__________(填“BaCl2”或“CaCl2”)溶液,与未选物质相比的优点是___________。将生成的沉淀过滤、洗涤、干燥、称量,得固体质量为bg,计算质量分数。 |
|
| 28. 计算题 | 详细信息 |
|
平达喜是常用的中和胃酸的药物,它的化学成分是AlxMgy(OH)zCO3·nH2O,其中氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol/L盐酸使其溶解,当逐滴加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤、洗涤,沉淀物进行干燥后重1.74g。请计算该试样中: (1)碳酸根的物质的量_____________; (2)镁离子的物质的量_____________; (3)通过计算确定该物质的化学组成为___________。 |
|
最近更新







