湖北省华师一附中、黄冈中学等八校2020届高三第一次联考理综化学题免费试卷
| 1. 选择题 | 详细信息 |
|
下列说法错误的是 A.港珠澳大桥用到的铝合金材料,具有强度大、密度小、耐腐蚀等性能 B.第五形态的碳单质“碳纳米泡沫”,与石墨烯互为同素异形体 C.唐代著名诗人杜牧在《泊秦淮》中写道“烟笼寒水月笼沙,夜泊秦淮近酒家”,文中的“烟”能产生丁达尔效应 D.我国西周时发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理 |
|
| 2. 选择题 | 详细信息 |
|
用NA表示阿伏加德罗常数的值,下列说法正确的是 A.标准状况下,2. 24 L Cl2溶于水充分反应,转移的电子数为0.1NA B.25℃时,pH =13的Ba(OH)2溶液中,OH-数目为0. 2NA C.5.4 gAl分别与浓度均为2 mol.L-1的NaOH溶液和盐酸各100 mL反应,生成H2的分子数均为0.3.NA D.31 g白磷(P4)分子中含有P-P键数目为1.5NA |
|
| 3. 选择题 | 详细信息 |
2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据元素性质、相对原子质量等进行排列,预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是 A.乙元素位于现行元素周期表第四周期第ⅥA族 B.原子半径:甲>乙> Si C.乙的简单气态氢化物的稳定性弱于CH4 D.推测乙的单质可以用作半导体材料 |
|
| 4. 选择题 | 详细信息 |
用下列实验方案能达到实验目的的是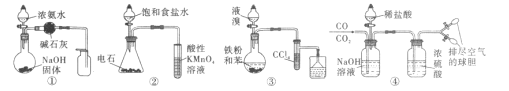 A.用图①的装置制取并收集干燥的NH3 B.用图②的装置验证乙炔的还原性 C.用图③的装置制取溴苯 D.用图④的装置分离CO和CO2 |
|
| 5. 选择题 | 详细信息 |
碳酸亚乙酯是一种重要的添加剂,其结构简式为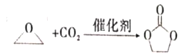 下列说法错误的是 下列说法错误的是A.碳酸亚乙酯中的所有原子处于同一平面内 B.碳酸亚乙酯的二氯代物只有两种 C.上述反应属于加成反应 D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH |
|
| 6. 选择题 | 详细信息 |
Mg-LiFePO4电池的电池反应为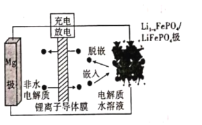 A.放电时,Li+被还原 B.放电时,电路中每流过2 mol电子,有1 mol Mg2+迁移至正极区 C.充电时,阳极上发生的电极反应为: D.充电时,导线上通过1 mol电子,左室溶液质量减轻12 g |
|
| 7. 选择题 | 详细信息 |
我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )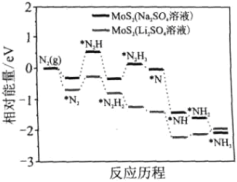 A. Li2SO4溶液利于MoS2对N2的活化 B. 两种电解质溶液环境下从N2→NH3的焓变不同 C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低 D. N2的活化是N≡N键的断裂与N—H键形成的过程 |
|
| 8. 实验题 | 详细信息 |
FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下: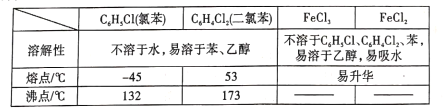 (1)用H2还原无水FeCl3制取FeCl2。有关装置如图1所示:  ①H2还原无水FeCl3制取FeCl2的化学方程式为________ 。 ②B中盛放的试剂是____,按气流由左到右的方向,上述仪器的连接顺序为 ____(填字母,装置可多次使用)。 ③该制备装置的缺点为______。 (2)利用反应 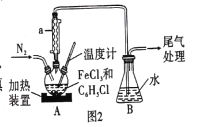 ①仪器a的作用是 _______。 ②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____(填名称),回收滤液中C6H5Cl的操作方法是____。 ③在反应开始之前先通一段时间N2的目的是 ____,在反应完成后继续通一段时间N2的作用是____ ④反应后将锥形瓶中溶液配成250 mL,量取25. 00 mL所配溶液,用0.40 mol·L-1 NaOH溶液滴定,重复上述操作3次,达到滴定终点时消耗NaOH溶液的体积分别为19. 50 mL、20. 50 mL、19. 70 mL,则氯化铁的转化率为____。 |
|
| 9. | 详细信息 |
氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。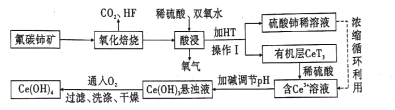 回答下列问题: (l)CeFCO3中Ce的化合价为____ 。 (2)氧化培烧时不能使用陶瓷容器,原因是________.。 (3)氧化焙烧后的产物之一为CeO2.则酸浸时发生反应的离子方程式为____。 (4)HT是一种难溶于水的有机溶剂,则操作I的名称为 _____。 (5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是____。 (6)有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) (7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:__________________________。 |
|
| 10. 综合题 | 详细信息 |
|
合理利用和转化NO2、SO2、CO、NO等污染性气体是环保领域的重要课题。 (1)用CH4催化还原氮氧化物可以消除氮氧化物污染。已知: ① ② ③ 1 mol CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的反应热为________。 (2)已知 ① ② 一定温度下,反应 (3)用活性炭还原法处理氮氧化物的有关反应为:  ①T℃时,该反应的平衡常数的计算式为______。 ②在31 min时,若只改变某一条件使平衡发生移动,40 min、50 min时各物质的浓度如上表所示,则改变的条件是____ ③在51 min时,保持温度和容器体积不变再充人NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。 (4)反应N2O4(g)  在T℃时,图中M、N点能表示该反应达到平衡状态,理由是___________ 。改变温度,v(NO2)会由M点变为A、B或C,v(N2O4)会由N点变为D、E或F,当升高到某一温度时,反应重新达到平衡,相应的点分别为_______(填字母)。 |
|
| 11. 综合题 | 详细信息 |
新型钙钛矿型太阳能电池以其稳定、高效、便宜和便于制造等优点被科学家所青睐。这种钙钛矿型太阳能电池材料为层状结构。具体如图1所示。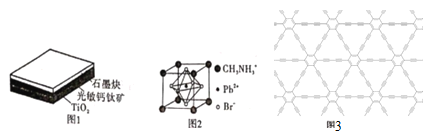 (1)基态Ti原子的电子排布式为____;同周期的基态原子与其未成对电子数相同的元素还有________种。 (2)光敏钙钛矿的晶胞结构如图2所示。 ①写出与CH3NH3+互为等电子体的一种分子的化学式:__,C、N、O三种元素的第一电离能由大到小的顺序为____(用元素符号表示),CH3NH3+中含有的化学键类型有____。 ②光敏钙钛矿的化学式为________;每个CH3NH3+周围最近且等距离的Br-数目为__。 ③若该光敏钙钛矿的摩尔质量为M g·mol-1,晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g.cm-3(用含M、a、NA的代数式表示)。 (3)石墨炔的结构如图3所示,其中碳原子的轨道杂化类型是 _____ ,36 g石墨炔中含有σ键的数目为____。 |
|
| 12. 推断题 | 详细信息 |
芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系: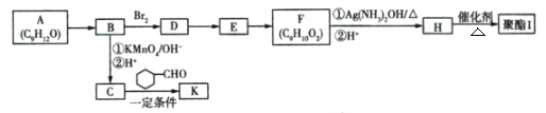 已知:①A的苯环上只有一个支链,支链上有两种不同化学环境的氢原子; ②  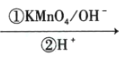  +CO2 +CO2 ③ 回答下列问题: (1)A生成B的反应条件为____,由D生成E的反应类型为_________。 (2)F中含有的官能团名称为________。 (3)K中含有两个六元环,则K的结构简式为 ______。 (4)由F生成H过程中①的化学方程式为_______ 。 (5)H有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式 __________。 ①能发生银镜反应 ⑦遇FeCl3溶液显色 ③具有4组核磁共振氢谱峰 (6)糠叉丙酮  为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________ 为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________ |
|
最近更新



