2017高二下学期人教版高中化学单元测试
| 1. | 详细信息 |
|
最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰。电池总反应式为Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是( ) A.该电池中Zn为负极,发生还原反应 B.该电池的正极反应式为MnO2+e-+H2O=2MnOOH+OH- C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn D.电池工作时内电路中OH-移动向MnO2一极
|
|
| 2. | 详细信息 |
|
在加入铝粉能产生氢气的溶液中,下列各组离子可能大量共存的是( ) A.Na+、 Ba2+、Cl-、NO3- B. Fe2+、 K+、NO3-、Cl- C.Na+、NH4+、AlO2-、 SO42- D.NH4+、ClO-、SO42-、Na+
|
|
| 3. | 详细信息 |
|
用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是 A. 给反应体系适当加热 B. 向反应体系中加水稀释 C. 加入少量氧化铜固体 D. 加压
|
|
| 4. | 详细信息 |
|
检验某无色溶液中是否含有I-,所用试剂不合理的是 A. 淀粉溶液和氯水 B. 硝酸酸化的硝酸银溶液 C. 氯水和四氯化碳 D. 溴水和酒精
|
|
| 5. | 详细信息 |
|
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的 A. 计算机芯片的材料是经提纯的二氧化硅 B. “地沟油”可以用来制肥皂和生物柴油 C. 硅胶、生石灰、铁粉是食品包装中常用的干燥剂 D. 铝及其合金应用广泛,是因为铝的冶炼方法比较简单
|
|
| 6. | 详细信息 |
|
根据相似相溶规则和实际经验,下列叙述不正确的是 ( ) A. 白磷(P4)易溶于CS2,但难溶于水 B. NaCl易溶于水,难溶于CCl4 C. 碘易溶于苯,微溶于水 D. 卤化氢易溶于水,也易溶于CCl4
|
|
| 7. | 详细信息 |
|
某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1, 由此可以得出的结论是 A. 分子中C、H的原子个数之比为1:2 B. 该有机物中必定含氧 C. 分子中C、H、O的原子个数之比为1:2:1 D. 该有机物属于烃类
|
|
| 8. | 详细信息 |
|
有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6,其发烟过程中的化学反应如下: ① 3ZnO + 2Al → Al2O3 + 3Zn ② 3Zn + C2Cl6 → 3ZnCl2 + 2C 下列有 A. 反应①是铝热反应 B. 反应②是置换反应 C. C2Cl6属于卤代烃 D. 氧化性:Al<Zn<C
|
|
| 9. | 详细信息 |
|
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是 A. 950mL,111.2g B. 500mL,117g C. 1000mL,117g D. 任意规格,111.2g
|
|
| 10. | 详细信息 |
|
常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体。NA A. pH=3的草酸溶液含有H+数目为0.001NA B. 当1molKMnO4被还原时强酸提供H+数目为NA C. 1molHOOC-COOH含共用电子对数目为9NA D. 该反应释放CO2分子数目为
|
|
| 11. | 详细信息 |
|
从下列基团:-CH3、-OH、-COOH、-C6H6,相互两两组成的有机物有 A. 3个 B. 4个 C. 5个 D. 6个
|
|
| 12. | 详细信息 |
|
下列关于如图所示电化学装置的分析正确的是( )
A. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 B. 若X为电流计,Y为锌棒,则SO42-移向Fe棒 C. 若X为导线,Y为铜棒,则Fe棒发生还原反应 D. 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
|
|
| 13. | 详细信息 | ||||||||||||||||||||
|
为了除去括号内的杂质,其试剂选择和分离方法都正确的是( )
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 14. | 详细信息 |
|
下列说法中正确的是( )。 A. 次外层电子数是2或8或18的原子一定是主族元素 B. 短周期元素中最外层电子数等于电子层数的元素有2种 C. 质量数表示同位素原子质量的近似值 D. 核外电子排布相同的微粒,一定具有相同的化学性质
|
|
| 15. | 详细信息 |
|
下列化合物中,可以通过置换反应一步得到的是( ) ①FeSO4 ②NaOH ③Fe3O4 ④Al2O3 A. ①②③④ B. ①②③ C. ①④ D. ①③
|
|
| 16. | 详细信息 |
|
下列有关有机化合物的说法正确的是 A. CH3CH==CHCH3分子中所有原子在一个平面上 B. C. CH2=CHCH2OH能发生加成发应、取代反应、氧化反应等 D. 结构为…—CH==CH—CH==CH—CH==CH—CH==CH—…的高分子化合物,其单体是乙烯
|
|
| 17. | 详细信息 |
|
下列说法不正确的是 A. B. 化合物CH3CH2NO2和H2NCH2COOH互为同分异构体 C. D. 白磷与红磷互为同素异形体
|
|
| 18. | 详细信息 |
|
工业上用电解法处理含镍酸
已知:①Ni2+在弱酸性溶液中发生水解; ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度) A. 碳棒上发生的电极反应:4OH−−4e−= O2↑+2H2O B. 为了提高镍的产率,电解过程中需要控制废水的pH C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少 D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
|
|
| 19. | 详细信息 |
|
有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol・L-1,c(Cl-)为1.3mol・L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol・L-1NaOH溶液的体积为 A. 40mL B. 72mL C. 80mL D. 128mL
|
|
| 20. | 详细信息 |
|
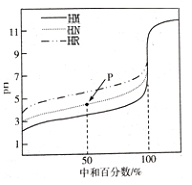
室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为O.1mol/L的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是
A. 三种酸的电离常数关系:KHM>KHN>KHR B. pH=7时,三种溶液中:c(M-)>c(N-)>c(R-) C. 当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+) D. 滴定至P点时,溶液中:c(HN)>c(N-)>c(Na+)>c(H+)>c(OH-)
|
|
| 21. | 详细信息 | ||||||||||||||||
|
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图
CH3CH2OH+HBr
(1)A装置的名称是______________。 (2)实验中用滴液漏斗代替分液漏斗的优点为_______________________。 (3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式________________________。 (4)给A加热的目的是________________________,F接橡皮管导入稀NaOH溶液,其目的主要是___________________。 (5)图中C中的导管E的末端须在水面以下,其目的是______________________。 (6)粗产品洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0 g。从乙醇的角度考虑,本实验所得溴乙烷的产率是________________。
|
|||||||||||||||||
| 22. | 详细信息 |
|
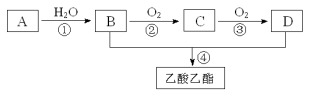
解气的主要成份。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。回答下列问题:
(1)A转化为B的反应类型___ (2)D分子中官能团的名称_______。 (3)写出B与金属钠反应的化学方程式是____________________。 (4)下列说法正确的是________________。 A.B分子中的所有原子在同一平面上 B.一定条件下,C中的官能团可以用银氨溶液来检验 C.A可以在其他条件下被氧气氧化成乙酸 D.A使酸性KMnO4溶液褪色和使溴水褪色,其原理相同 (1)加成反应(1分)(2)羧基(1分)。 (3)2CH3CH2-OH+2Na→2CH3CH2-ONa+H2↑(2分)(4)BC(2分
|
|