2019宁夏高三上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
化学与生活关系密切,下列说法正确的是 A.泡沫灭火器可用于一般的起火,也适用于电器起火 B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 C.明矾可用于生活用水的消毒 D.碳酸钡可用于胃肠X射线造影检查
|
|
| 2. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A.用惰性电极电解CuSO4溶液一段时间后,若加入29.4 gCu(OH)2 能使溶液复原,则电解过程中转移电子的数目为0.9NA B.0.1molNa2O2与过量的CO2和H2O混合气体充分反应后,放出的O2为0.2NA C.常温常压下,1molSiO2晶体中有2NA个Si-O键 D.18gH218O和2H2O的混合物中,所含中子数为9NA
|
|
| 3. | 详细信息 |
|
下列化学过程及其表述正确的是 A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O B.水电离的C (H+) =10-13mol·L-l 的溶液中;Na+、NO3-、SO32-、Cl-一定能大量共存 C.水溶液中NH4+ 、Al3+、AlO2-都能和HCO3-发生双水解反应从而不能大量共存 D.加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+ 能大量共存
|
|
| 4. | 详细信息 |
|
下列实验操作叙述和结论正确的是 A. 恒温下向澄清石灰水中加入少量CaO有Ca(OH)2固体析出,则此状态下Ca(OH)2的质量分数减小,KSP不变 B.除去NH4Cl溶液中的少量Fe3+,可以加入NaOH调节溶液PH后过滤结晶 C.直接蒸干FeSO4溶液就可以得到FeSO4固体 D.实验室制备FeCl2溶液时会加入盐酸防止水解,并加入少量铁粉防止氧化
|
|
| 5. | 详细信息 |
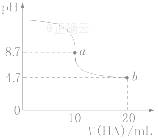
|
室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元 酸HA,溶液pH的变化曲线如图所示。下列说法正确的是 A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA)
|
|
| 6. | 详细信息 |
|
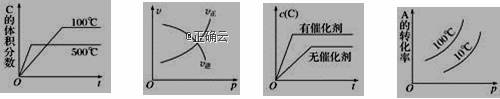
下列图中,表示2A(g)+B(g)⇌ 2C(g) ΔH<0可逆反应的图像为
A. B. C. D.
|
|
| 7. | 详细信息 |
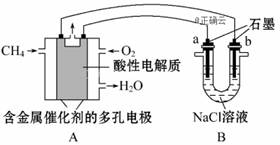
|
A.电源B 端是正极 B.f 极附近红褐色变深,说明氢氧化 铁胶粒带正电 C.欲用丁装置给铜镀银,N 应为Ag, 电解质溶液为AgNO3溶液 D.a、c电极均有单质生成它们的物质的量之比为2∶1
|
|
| 8. | 详细信息 |
|
元素化合物在日常生活、化工生产和环境科学中有着重要的用途。 (1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的黑色固体Y,将Y溶于过量盐酸中,溶液中存在的阳离子有______________ (2)将题(1)中反应后生成的溶液分为a,b,c三份,a中加入适量的KNO3溶液,发生的离子反应为_________________,b中加入过量Na2O2,观察到的现象是_____________________,c中通入足量SO2,发生的离子反应为_____________ (3)取少量固体Y与金属铝在高温下反应方程式为_____________,若要提纯产物中的金属单质,应先加入足量的_________溶液再过滤,此时发生的反应方程式为________________
|
|
| 9. | 详细信息 | ||||||
|
25 ℃时,部分物质的电离常数如表所示:
请回答下列问题: (1)相同PH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________ (2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。 A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-) (3)现有10mLPH=2的盐酸溶液,进行以下操作: a.与PH=5的盐酸等体积混合,则PH=_____________ b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________ c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________ d. 下列关于体积都为10mL,PH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。 ①与等量的锌反应开始反应时的速率A=B ②与等量的锌反应所需要的时间A>B ③加水稀释100倍,PH大小比较:4=A>B>2 ④物质的量浓度大小比较:A>B ⑤分别与10mLPH=12的NaOH溶液充分反应后的溶液PH大小比较:A<B e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。 A.未用HCl标准溶液润洗滴定管 B.滴定前锥形瓶内有少量水 C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 D.观察读数时,滴定前仰视,滴定后俯视
|
|||||||
| 10. | 详细信息 | ||||||||||||||||||||
|
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题: (1)基态Fe原子价层电子排布式为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形,共有______能量不同的原子轨道 (2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他 分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_______。 (4)气态H2S的分子的立体构型为_____形,固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。 (5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm−3
|
|||||||||||||||||||||
| 11. | 详细信息 | |||||||||||||||||||||||||||||||||
|
工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。 I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量); N2(g) + 2O2(g) = 2NO2(g) △H= +133 kJ/mol H2O(g) =H2O(l) △H=- 44 kJ/mol 催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为_____ Ⅱ.脱碳: (1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 : CO2(g)+3H2(g) ⇌ CH3OH(l)+H2O(l)。下列叙述能说明此反应达到平衡状态的是________。 A.混合气体的平均摩尔质量保持不变 B.CO2和H2的体积分数保持不变 C.CO2和H2的转化率相等 D.混合气体的密度保持不变 E.1 mol CO2生成的同时有3 mol H—H键断裂 (2)改变温度,使反应CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g)△H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
①达到平衡时,反应I、II对比:平衡时CH3OH的浓度c(I)___________c(II)。 (填“>”“<”或“=”,下同);将反应I的条件改为绝热恒容,平衡时的平衡常数与反应I的比较_________(填“增大”“减小”或“不变”) ②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=________ ,在其他条件不变下,将温度改为T2,测得30min时,H2的物质的量为3.2mol,则T1____T2(填“>”“<”或“=”)若30min时只向容器中再冲入1molCO2(g)和1molH2O(g),则平衡_______移动(填“正向”、“逆向”或“不”) (3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1mol·L -1食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。
①甲烷燃料电池的负极反应式: ____________________________________ ②电解后溶液的pH= __________________________(忽略氯气与氢氧化钠溶液反应)。
|
||||||||||||||||||||||||||||||||||
| 12. | 详细信息 |
|
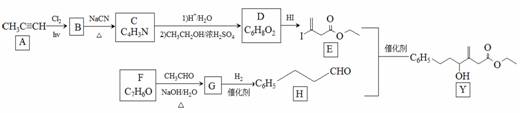
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:
已知: 回答下列问题: (1)A的化学名称是________________。 (2)B为单氯代烃,由B生成C的化学方程式为________________。 (3)由A生成B、G生成H的反应类型分别是________________、________________。 (4)D的结构简式为________________。 (5)Y中含氧官能团的名称为________________。 (6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。 (7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出2种符合上述条件的X的结构简式_____________。
|
|