2018黑龙江高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
生活处处有化学,下列说法正确的是: A.棉花与淀粉互为同分异构体B.豆浆煮沸后,蛋白质变成了氨基酸 C.纤维素与蛋白质都是天然高分子化合物 D.油脂在酸性条件下可水解为高级脂肪酸盐和甘油
|
|
| 2. | 详细信息 |
|
下列说法错误的是: A.中子数为20的氯原子: C.乙醛的结构简式:CH3COH D.比例模型
|
|
| 3. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列说法不正确的是: A.15 g ﹣CH3( 甲基 )含有中子数为6 NA B.5.6 g Fe粉完全溶于HCl和H2SO4的混合稀溶液,生成气体分子的数目为0.1 NA C.标准状况下,2.24 L NO2与N2O4的混合气体中含有氮原子的数目为0.1 NA D.在过氧化钠与CO2的反应中,每生成0.1 mol氧气,转移电子的数目为0.2NA
|
|
| 4. | 详细信息 |
|
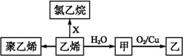
乙烯的相关转化关系如图。下列有关说法正确的是:
A. 聚乙烯是纯净物 B. X为Cl2 C.CH3OCH3与甲互为同分异构体 D. 甲→乙反应类型为取代反应
|
|
| 5. | 详细信息 |
|
下列物质性质与应用对应关系正确的是: A.火碱能与酸反应,可用于治疗胃酸过多 B.晶体硅硬度大,可用于制作半导体材料 C.SO2具有还原性,可用于漂白纸浆 D.MgO、Al2O3熔点高,它们都可用于制作耐火材料
|
|
| 6. | 详细信息 |
|
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(N2O、N2O4、NO2)的混合物,这些气体恰好能被500mL、2mol/LNaOH溶液完全吸收,生成NaNO3和NaNO2两种盐溶液,其中NaNO2的浓度为 A.0.4 mol/L B.1.2 mol/L C.1.6mol/L D.2.0 mol/L
|
|
| 7. | 详细信息 |
|
在由水电离的c(H+) = 10-12mol/L的溶液中,下列离子组一定能大量共存的是: A.Na+、K+、Cl‾、NO 3‾ B.K+、Na+、ClO‾、SO42- C.Al3+、Cu2+、Cl‾、S2- D.Na+、Fe2+、NO3-、Cl-
|
|
| 8. | 详细信息 |
|
下列关于电解质溶液的叙述正确的是: A.在pH=3的溶液中,Na+、Cl﹣、Fe2+、ClO﹣可以大量共存 B.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl﹣)>c(NH4+)>c(H+)=c(OH﹣) D.向0.1molL﹣1的氨水中加入少量硫酸铵固体,则溶液中c(OH﹣)/c(NH3·H2O)增大
|
|
| 9. | 详细信息 |
|
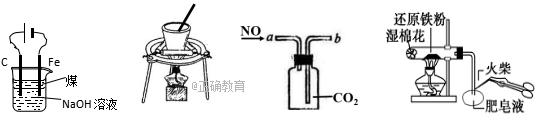
用下列实验装置进行相应实验,不能达到实验目的的:
A.图1: 实验室制备Fe(OH)2 B.图2: 从NaCl与I2的混合物中回收I2 C.图3: 收集NO气体 D.图4: 检验铁粉与水蒸气反应产生的氢气
|
|
| 10. | 详细信息 |
|
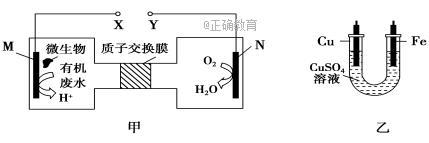
如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是:
A.铜电极应与X相连接 B.H+透过质子交换膜由左向右移动 C.M电极反应式为CO(NH2)2+H2O-6e-===CO2↑+N2↑+6H+ D.当N电极消耗0.25 mol气体时,则理论上铁电极增重32 g
|
|
| 11. | 详细信息 |
|
下列说法正确的是: A.用惰性电极电解含酚酞的饱和食盐水,阳极附近溶液先变红 B.铜的电解精炼过程中,有0.2 mol 电子发生转移时,阳极一定有6.4 g铜溶解 C.将地下钢管与直流电源的正极相连,称为外加电源的阴极保护法 D.在中性环境中,每生成35.6 g铁锈(Fe2O3·H2O),消耗的氧气为6.72 L(标准状况)
|
|
| 12. | 详细信息 |
|
下列有关说法正确的是( ) A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 B.2NO(g)+2CO(g) C.加热0.1 mol·L-1 Na2CO3溶液,C D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
|
|
| 13. | 详细信息 | ||||||||||
|
在2 L恒容绝热(不与外界交换能量)容器中进行2A(g)+B(g)
A.该反应的△H >0 B.温度升高,该反应的平衡常数减小 C.到达平衡时,n(B) = 0.5 mol D.平衡后,增加D的量,平衡逆向移动
|
|||||||||||
| 14. | 详细信息 |
|
.在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过H2O。以下叙述正确的是( ) A.硫酸盐都易溶于水 B.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品 C.分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3∶2∶3 D.明矾含有结晶水,是混合物
|
|
| 15. | 详细信息 |
|
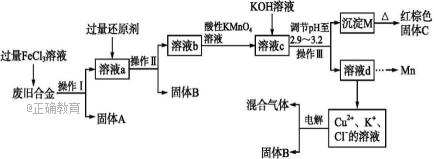
下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
已知:298 K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13。 根据上面的流程回答有关问题: (1)操作Ⅰ、Ⅱ、Ⅲ指的是 。 (2)加入过量FeCl3溶液过程中与较活泼的金属反应的离子方程式为 。 (3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。 (4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。 ②若用X mol·L-1 KMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。 (5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为 > > 。(填金属阳离子)
|
|
| 16. | 详细信息 |
|
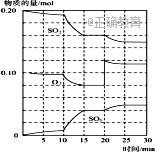
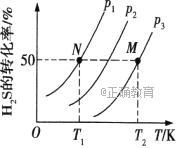
硫单质及其化合物在工农业生产中有着重要的应用。请回答下列问题: (1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下: ①CaSO4(s)+CO(g) ②1/4CaSO4(s)+CO(g) K的表达式为。 (2)图1为在密闭容器中H2S气体分解生成H2和S2(g)的平衡转化率与温度、压强的关系。
图1 图2 图1中压强p1、p2、p3的大小顺序为;该反应平衡常数的大小关系为K(T1)K(T2) (填“>”、“<”或“=”) (3)在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g) ①600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图2,反应处于平衡状态的时间段是。 ②据图2判断,反应进行至20min时,曲线发生变化的原因是(用文字表达);10min到15min的曲线变化的原因可能是(填写编号)。 A.加了催化剂 B.缩小容器体积C.降低温度 D.增加SO3的物质的量(4)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示)。
|
|
| 17. | 详细信息 |
|
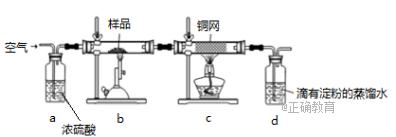
黄铜矿(主要成分为CuFeS2,S为-2价)是工业炼铜的主要原料,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,设计了如下实验:
现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,发生如下反应: 3CuFeS2+8O2 ==3Cu+Fe3O4+6SO2
(1)该反应中氧化产物是, (2)将样品研细后再反应,其目的是 ;装置c的作用是 。 (3)用标准碘溶液滴定d中溶液的离子方程式是,滴定达终点时的现象是 。 (4)上述反应结束后,仍需通一段时间的空气,其目的是 。 (5)通过计算可知,该黄铜矿的纯度为 。
|
|