2020江西高三上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
下列对古文献记载内容理解错误的是( ) A、《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐。 B、《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作 C、《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和槽入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏。 D、《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
|
|
| 2. | 详细信息 |
|
下列有关物质性质与用途具有对应关系的是( ) A、AgBr淡黄色难溶于水,可用于制作感光材科 B、NH3沸点高易液化,可用作致冷剂 C、浓硫酸具有脱水性,可用于干燥Cl2 D、SiO2熔点高硬度大,可用于制光导纤维
|
|
| 3. | 详细信息 | |||||||||||||||
|
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
|
||||||||||||||||
| 4. | 详细信息 |
|
2020年是“2025中国制造”关键年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是( ) A、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” B、我国发射“嫦娥三号”卫星所使用的碳纤维是一种非金属材料 C、用聚氯乙烯代替木材生产快餐盒,以减少木材的使用 D、碳纳米管表面积大,可用作新型储氢材料
|
|
| 5. | 详细信息 |
|
下列关于溶液和胶体的叙述,正确的是( ) A、溶液是电中性的,胶体是带电的 B、向FeCl3溶液中加入Na2CO3溶液,会有红褐色沉淀生成属于胶体聚沉 C、制备氢氧化铁胶体的方法是向饱和氯化铁溶液中加入氨水 D、用丁达尔效应可区别NaCl溶液和Fe(OH)3胶体
|
|
| 6. | 详细信息 | |||||||||||||||
|
下列根据实验操作和实验现象所得出的结论不正确的是( )
|
||||||||||||||||
| 7. | 详细信息 |
|
设NA为阿伏加德罗常数的数值。下列说法正确的有( ) ① 3 mol单质Fe完全转化为Fe304,失去9NA个电子 ② 标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA ③ 32gS8(分子结构: ④常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA ⑤ 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA ⑥浓硫酸(含1molH2SO4)与足量 Cu加热发生反应生成0.5NA个SO2分子 ⑦标准状况下,22.4 L N2和H2的混合气休中含有NA个原子 ⑧23gNa与足量H20反应完全后可生成NA个氢气分子 A、一项 B、两项 C、三项 D、四项
|
|
| 8. | 详细信息 |
|
下列离子方程式正确的是( ) A、NaHCO3溶液与NaAlO2溶液混合后产生白色沉淀:HCO3- + AlO2-+ H2O=Al(OH)3↓+ CO2 B、用稀硝酸清洗试管内壁的银镜:Ag + 2H++ NO3-=Ag++ NO2↑+ H2O C、用NaOH溶液除去镁粉中含有的杂质铝:2Al+ 2Na++2OH-+ 2H2O=2NaAlO2+ 3H2↑ D、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42-完全沉淀: NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+NH3·H2O+2BaSO4↓
|
|
| 9. | 详细信息 | |||
|
下列有关化学用语的用法中,正确的是( ) A、BaCO3的电离方程式: B、向酸性KI溶液中通入臭氧(O3)的离子方程式: C、向沸水中滴加饱和氯化铁溶液得到红褐色液体的化学方程式: D、向Ba(OH)2溶液中滴入NaHSO4溶液至恰好完全沉淀时,反应的离子方程式
|
||||
| 10. | 详细信息 |
|
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是( ) A、将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 C、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 D、将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
|
|
| 11. | 详细信息 |
|
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液组成,还需检验的离子是( ) A、 Na+ B、SO42- C、 Ba2+ D、NH4+
|
|
| 12. | 详细信息 |
|
在溶液中加入足量的过氧化钠后仍能大量共存的离子组是( ) A、K+、Cu2+、Cl-、SO42- B、K+、AlO2-、NO3-、CO32- C、Na+、Cl-、NO3-、SO32- D、Ca2+、M2+、Cl-、HCO3-
|
|
| 13. | 详细信息 |
|
将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为( ) A、0.1 mol/L B、0.2 mol/L C、0.4 mol/L D、0.8 mol/L
|
|
| 14. | 详细信息 |
|
聚合硫酸铁[Fe(OH)S04]n能用作净水剂(絮凝剂),可由绿矾(FeSO4 •7H2O)和KCl03在水溶液中反应得到。下列说法不正确的是( ) A、聚合硫酸铁可在水中形成氢氧化铁胶体而净水 B、KC103作氧化剂,每生成 1 mol [Fe(OH)SO4]n消耗 C、生成聚合硫酸铁后,水溶液的pH增大 D、在相同条件下,Fe3+比[Fe(OH)]2+的水解能力更强
|
|
| 15. | 详细信息 |
|
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列选项的编号和曲线的编号一一对应,其中描述错误的是( ) A、向NaAlO2溶液中逐渐滴入HCl至过量 B、向澄清石灰水中通入CO2至过量 C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
|
|
| 16. | 详细信息 |
|
已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系,下列推断不合理的是( ) A、X可能是一种氢化物 B、Y可能直接转化为E C、Y不可能转化为X D、若X是单质,则X转化为Y的反应可能是化合反应
|
|
| 17. | 详细信息 |
|
已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
(1)写出化学式:A________,B________,J________; (2)反应③中每生成1 mol F,转移电子的数目为______________; (3)反应④的化学方程式为:______________________________; (4)写出离子方程式:反应②________________________________, 反应⑤________________________________________________。
|
|
| 18. | 详细信息 |
|
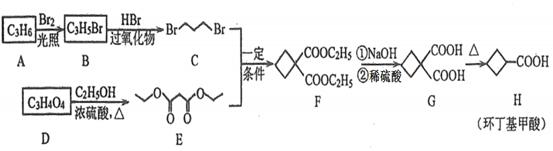
环丁基甲酸是重要的有机合成中间体,以下是用烯烃A和羧酸D合成它的一种路线:
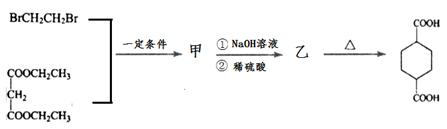
回答下列问题: (1)A的结构简式为__________; (2)B→C的反应类型为__________,该反应还能生成一种与C互为同分异构体的副产物,该副产物的结构简式为____________; (3) D→E的化学方程式为_____________; (4) M是H的同分异构体,写出同时满足下列条件的M的结构简式__________;(不考虑立体异构) ①1molM与足量银氨溶液反应生成4molAg;②核磁共振氢谱为两组峰。 (5)根据上述合成路线中的信息,某学习小组设计以丙二酸二乙酯和1,2-二溴乙烷为原料合成二甲酸环己烷的流程图如下。则甲的结构简式为_______,乙的结构简式为_______。
|
|
| 19. | 详细信息 | ||||
|
今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
现取三份上述澄清溶液各100 mL,分别进行以下实验: ①第一份加入AgNO3溶液有沉淀产生。 ②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。 ③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。 请回答下列问题: (1)根据第②个实验可以确定存在的离子是_______; (2)除(1)中确定存在的离子以外,还一定存在的离子是__________,可能存在的离子是______; (3)第③个实验中沉淀减少的原因是(用离子方程式表示)______________________________。
|
|||||
| 20. | 详细信息 |
|
雄黄 (As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空: (1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 (2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。 (3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- = 2H3AsO4+ 3S+10NO2↑+ 2H2O 若生成2mol H3AsO4,则反应中转移电子的物质的量为 (4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (填字母) a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
|
|
| 21. | 详细信息 |
|
次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。 【查阅资料】资料1:常温常压下,Cl2O为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2和O2, Cl2O易溶于水并与水立即反应生成 HClO。 资料2:将氯气和空气(不参与反应)按体积比 1∶3 混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O 【装置及实验】用以下装置制备次氯酸溶液
回答下列问题: (1)各装置的连接顺序为_____→_____→_____→____→E; (2)装置 A 中反应的离子方程式是__________________; (3)装置 E中反应的化学方程式是_____________________; (4)装置 B 中多孔球泡和搅拌棒的作用是____,反应过程中,装置B需放在冷水中,其目的是____。 (5)装置 C 的主要作用是_____________________; (6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)______________。 (7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。 (8)配平下列离子方程式: Fe(OH)3+ ClO
|
|
| 22. | 详细信息 |
|
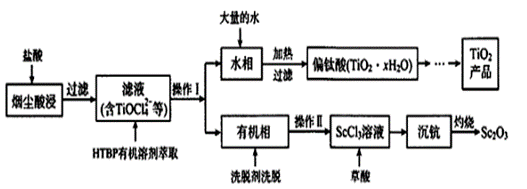
钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如图所示:
(1)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为___________________; (2)“水相”的主要离子有TiOCl42-、H+、Cl-及Mg2+,写出加入大量的水并加热发生的相关离子反应方程式________________;
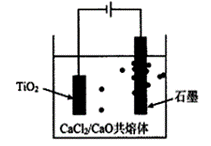
(4)钛的冶炼新法是剑桥电解法(如图)。以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。利用中学所学知识可以预测CaCl2的作用包含增强导电性及_______。
|
|
- 河北省沧州市普通高中高三上学期教学质量监测化学考试题
- 2017-2018年高一上学期期中考试化学考卷带参考答案和解析(甘肃省靖远一中)
- 2017-2018年高一上学期期中考试化学考试(西藏林芝市第二中学)
- 2018年高考化学二轮专题复习 综合复习:有机化学(备考)
- 2017-2018年高三前半期化学期中考试考试题(吉林省白山市抚松五中、长白山实验中学、长白山二中、长白山实验中学联考)
- 2019届高三9月月考化学题开卷有益(山西省朔州市应县第一中学)
- 北京高二化学期末考试(2018年下期)试卷带答案和解析
- 高中化学人教版 必修2 第一章 物质结构 元素周期律 第二节 元素周期律 元素周期表和元素周期律的应用