2019广东高一上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
标准状况下,往100mL 0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是 A. 0.224L B. 0.336L C. 0.448L D. 0.672L
|
|
| 2. | 详细信息 |
|
下列关于物质分类的说法正确的是 A. 胆矾、石膏、漂白粉都是纯净物 B. 氢氧化钙、盐酸、硫酸铜均为强电解质 C. 氯化钙、烧碱、聚苯乙烯均为化合物 D. 稀豆浆、鸡蛋清溶液、雾均为胶体
|
|
| 3. | 详细信息 |
|
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是 A. 配制过程只需要三种仪器即可完成 B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 C. 所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 D. 需要称量NaClO固体的质量为140 g
|
|
| 4. | 详细信息 |
|
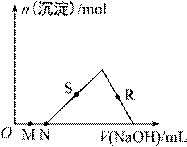
向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是
A. M点对应的溶液中:K+、Fe2+、SO42-、NO3- B. N点对应的溶液中:K+、NH4+、Cl-、CO32- C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3- D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
|
|
| 5. | 详细信息 |
|
分类是学习和研究化学的一种常用的科学方法。下列分类合理的是 ①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 ②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 ③同位素:1H、2H、3H;干冰、液氯都是非电解质 ④电解质:明矾、冰醋酸、纯碱;同素异形体:C60、金刚石、石墨 ⑤根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 A. 只有②④ B. 只有②③⑤ C. 只有①②④ D. 只有②③⑤
|
|
| 6. | 详细信息 |
|
设NA为阿伏加德罗常数的值,下列叙述正确的是 A. 15g甲基(-CH3)含有的电子数是9NA B. 7.8g苯中含有的碳碳双键数为0.3NA C. 1mol C2H5OH和1mol CH3CO18OH反应生成的水分子中的中子数为8NA D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
|
|
| 7. | 详细信息 |
|
下列关于离子检验的说法中正确的是 A. 向某溶液中加入澄清石灰水,溶液变浑浊,则该溶液一定含有CO32- B. 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- C. 向某溶液中加入盐酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- D. 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
|
|
| 8. | 详细信息 |
|
下列表示对应化学反应的离子方程式正确的是 A. Fe3O4与足量稀HNO3反应: Fe3O4+8H+=2Fe3++Fe2++4H2O B. 用小苏打治疗胃酸过多:NaHCO3+H+=Na++CO2↑+H2O C. 双氧水中加入稀硫酸和KI溶液:H2O2 + 2H+ + 2I- = I2 + 2H2O D. 往碳酸氢钙溶液中滴入少量氢氧化钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
|
|
| 9. | 详细信息 |
|
下列说法或实验操作不正确的是 A. 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中 B. 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出 C. NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热 D. 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热。
|
|
| 10. | 详细信息 |
|
已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且 A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol B. 改变温度,产物中NaCl的最小理论产量为4a mol C. 参加反应的氯气的物质的量为6a mol D. 某温度下,若反应后
|
|
| 11. | 详细信息 |
|
下列有关说法正确的是 A. 氯化钠溶液均一、稳定、透明,不是分散系 B. “冰水混合物”是一种分散系 C. 分散系有的是纯净物,有的是混合物 D. 分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合可能有9种方式
|
|
| 12. | 详细信息 |
|
配制0.1mol•L﹣1的NaOH溶液,下列操作会导致所配的溶液浓度偏高的是 A. 用敞口容器称量NaOH且时间过长 B. 定容时俯视读取刻度 C. 原容量瓶洗净后未干燥 D. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
|
|
| 13. | 详细信息 |
|
有反应方程式:Cu + 2H2SO4(浓) ∆ CuSO4 + SO2 ↑+ H2O,当32gCu完全反应时,被还原的H2SO4的物质的量为(已知:MCu= 64 g/mol) A. 0.5mol B. 1.0mol C. 1.5mol D. 2.0mol
|
|
| 14. | 详细信息 |
|
下列说法正确的是 A. 液溴易挥发,在存放液溴的试剂瓶中应加水封 B. 铝箔燃烧后不掉落的原因是铝的熔沸点比较高 C. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 D. 溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
|
|
| 15. | 详细信息 | |||||||||||||||
|
分类法是研究化学的一种重要方法,下列乙中的物质与甲的分类关系匹配的是
A. A B. B C. C D. D
|
||||||||||||||||
| 16. | 详细信息 |
|
.agFe2O3和A12O3组成的混合物全部溶于20mL pH=1的硫酸,反应后向所得溶液中加入10mLNaOH溶液,恰好使Fe3+、A13+完全沉淀,则c(NaOH)为 A. 0.1mol·L-1 B. 0.2mol·L-1 C. 0.4mol·L-1 D. 0.8mol·L-1
|
|
| 17. | 详细信息 |
|
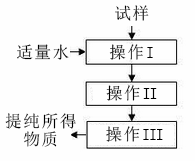
实验室按照下图所示的操作程序用于提纯某种物质,下列分析一定正确的是
A. 该操作流程可用于分离水与四氯化碳 B. 操作I-定是过滤,目的是将固液分离 C. 可以用于从四氯化碳中提取碘单质 D. 可以提纯含少量BaSO4的NaCI固体混合物
|
|
| 18. | 详细信息 |
|
下列关于钠的叙述中,正确的是 A. 钠露置在空气中最终变为过氧化钠固体 B. 钠能从溶液中置换出金属活动顺序表中钠后面的金属 C. 钠蒸气充入灯泡中制成钠灯,常用于公路照明 D. 金属钠着火时,能用泡沫灭火器来灭火
|
|
| 19. | 详细信息 |
|
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为_________________________________________,反应后得到的溶液呈_______色。用此溶液进行以下实验: (2)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为____________________________。 (3)另取少量原溶液于试管中,滴入KSCN溶液,则溶液呈________色,离子方程式为_______________________________,加入足量的铁粉,溶液变为浅绿色,离子方程式为__________________________________。 (4)取)(2)中所得浅绿色溶液于试管中,加入NaOH溶液得到白色沉淀,露置在空气中所观察到的现象为_____________________________,该反应的化学方程式为______________________________________。
|
|
| 20. | 详细信息 |
|
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。 (1)3He是高效核能原料,其原子核内中子数为_____________。 (2)Na的原子结构示意图为______。 (3)MgCl2在工业上应用广泛,可由MgO制备。 ①月球上某矿石经处理得到的MgO中含有少量SiO2,用NaOH溶液除去SiO2的化学方程式为______。 ②MgO与炭粉和氯气在一定条件下反应可制备MgCl2,尾气中的氯气可用足量冷的NaOH溶液完全吸收,则生成的盐为_________、_________(写化学式)。
|
|
| 21. | 详细信息 |
|
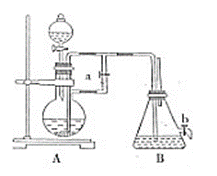
如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化的须色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。完成下列问题:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_______________,A中发生反应的目的是_____________________________。 (2)实验开始时应先将弹簧夹a________(填“打开”或“关闭”)。 (3)装置B中生成Fe(OH)2的操作及观察到的现象为_______________。 (4)实验完毕,打开b处弹簧夹,放入一部分空气,此时B中发生的反应为_________________________。
|
|
| 22. | 详细信息 |
|
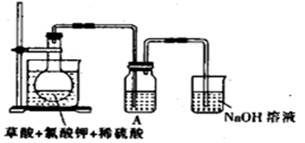
二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为2KClO3+H2C2O4+2H2SO4 ①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是__________________,图示装置中缺少的一种必须的玻璃仪器是_______。 ②装置A用于溶解产生的二氧化氯气体,其中最好盛放_________(填字母)。 A.20mL 60℃的温水 B.100mL冰水 C.100mL饱和食盐水 D.100mL沸水 ③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为__________________ (2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定,实验步骤如下: 步骤1:准确量取一定体积的水样加入锥形瓶中; 步骤2:调节水样的pH至7.0~8.0; 步骤3:加入足量的KI晶体; 步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点; 步骤5:再调节溶液的pH≤2.0; 步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。 ①步骤1中若要量取20.00mL水样,则应选用的仪器是_______________。 ②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:2ClO2+2KI=2KClO2+I2,2Na2S2O3+I2=Na2S4O6+2NaI,则步骤4中加入的指示剂为_____________,滴定达到终点时溶液的颜色变化为____________________。 ③步骤5的目的是使I-将溶液中的ClO2-还原为Cl-以测定其含量,该反应的离子方程式为:_____________________________________________。 ④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原为Cl-,则该反应的氧化产物为_____(填化学式)。
|
|