2017四川高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列能源在使用时对环境无污染或污染很小,且可以再生的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能. A.①②③④ B.⑤⑥⑦⑧ C.①③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
|
|
| 2. | 详细信息 |
|
下列元素位于d区的是( ) A.C B.Ca C.Cr D.Ga
|
|
| 3. | 详细信息 |
|
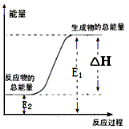
下列反应属于氧化还原反应,且能量变化如下图所示的是( )
A.锌粒和稀硫酸反应 B.灼热的木炭与CO2反应 C.甲烷在空气中燃烧的反应 D.Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
|
|
| 4. | 详细信息 |
|
下列有关叙述或化学用语表示正确的是( ) A.S2-的结构示意图: C.Ge原子的简化电子排布式:4s24p2 D.氯化钠的分子式:NaCl
|
|
| 5. | 详细信息 |
|
设NA为阿伏伽德罗常数的值,下列叙述不正确的是( ) A.含16g氧原子的二氧化硅晶体中含有的σ键数目为2NA B.1mol甲基(—CH3)所含电子数为9NA C.12克石墨中含有的共价键数目为1.5NA D.2molSO2和1molO2在一定条件下反应所得混合气体分子数等于2NA
|
|
| 6. | 详细信息 |
|
PH3 是一种无色剧毒气体。下列判断错误的是( ) A.PH3 分子是非极性分子 B.PH3分子中有一对电子孤对 C.PH3 分子VSEPR模型的名称是四面体 D.PH3 分子稳定性低于 NH3 分子
|
|
| 7. | 详细信息 |
|
甲醇属于可再生能源,可代替汽油作为汽车燃料。下列热化学方程式中的反应热能正确表示甲醇燃烧热的是( ) A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=+726.5kJ·mol-1 B.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ·mol-1 C.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) △H=-675.3kJ·mol-1 D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453kJ·mol-1
|
|
| 8. | 详细信息 |
|
已知C(s)+H2O(g)=CO(g)+H2(g) △H=akJ·mol-1 2C(s)+O2(g)=2CO(g) △H=-220kJ·mol-1 H-H 、O=O 、O-H的键能分别为436kJ·mol-1 、496kJ·mol-1 、462kJ·mol-1 ,则a为( ) A.-332 B.-118 C.+350 D.+130
|
|
| 9. | 详细信息 |
|
下列微粒的立体结构的名称正确的是( ) A.SO2 直线形 B.NH4+正四面体形 C.CS2 平面三角形 D.BF3 三角锥形
|
|
| 10. | 详细信息 |
|
有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( ) A.A3BC4 B.A2BC4 C.A2BC3 D.A4BC4
|
|
| 11. | 详细信息 |
|
下列各选项所述的两个量,前者一定大于后者的是( ) A.Ag+、Cu2+与NH3形成配合物时的配位数 B.NaCl的晶格能与MgO的晶格能 C.H-F键的极性与H-O键的极性 D.BF3的键角CS2的键角
|
|
| 12. | 详细信息 |
|
下列对分子结构及其性质的解释中,不正确的是( ) A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 B.乳酸属于手性分子,因分子中存在手性碳原子 C.配合物中一定含有过渡金属原子或离子,因为过渡金属原子或离子存在空轨道 D.酸性H3PO4>HClO,是因为H3PO4分子非羟基氧原子数目比HClO多
|
|
| 13. | 详细信息 |
|
下列叙述正确的是( ) A.离子晶体中,只存在离子健,不可能存在其它化学键 B.可燃冰中甲烷分子与水分子之间存在氢键 C.Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 2 D.晶体熔点:金刚石>食盐>冰>干冰
|
|
| 14. | 详细信息 |
|
已知:H—Cl和H—I键能分别为431kJ/mol和297kJ/mol,下列性质比较正确且可用键能数据说明原因的是( ) A.稳定性:HI>HCl B.熔、沸点:HI>HCl C.同浓度的HI和HCl的酸性:HI>HCl D.还原性:HI>HCl
|
|
| 15. | 详细信息 |
|
下列事实不能用勒夏特列原理解释的是( ) A.溴水存在:Br2+H2O B.为提高合成氨反应的产率,可采取降低温度的措施 C.反应CO(g)+NO2(g) D.可逆反应:2HI(g)
|
|
| 16. | 详细信息 |
|
密闭容器中有如下反应:mA(g)+nB(g) A.m+n>p B.A的转化率降低 C.平衡向正反应方向移动 D.C的质量分数增加
|
|
| 17. | 详细信息 |
|
向恒温恒容的密闭容器中充入amolX和bmolY,发生反应X(g)+3Y(g) A.1 3 B.3 1 C.3 2 D.1 2
|
|
| 18. | 详细信息 |
|
对于可逆反应 2AB3(g)
|
|
| 19. | 详细信息 |
|
定量的稀硫酸与过量锌粉反应,为了减慢反应速率但又不影响生成氢气总量的措施是( ) A.加入少量NaOH溶液 B.加入少量的NaHSO4溶液 C.加入少量的CH3COONa溶液 D.加入少量的CuSO4溶液
|
|
| 20. | 详细信息 |
|
某温度下,在一容积可变的容器中,反应2A(g)+B(g) A.均增加1mol B.均减小1mol C.均减半 D.均加倍
|
|
| 21. | 详细信息 |
|
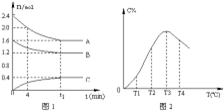
在10L定容密闭容器中,A、B、C三种气态物质构成了可逆反应的体系,当在某一温度时,A、B、C物质的量与时间的关系如图1,C的百分含量与温度的关系如图2。 下列分析不正确的是( )
A.t1时刻前,混合气体的密度减小,t1时刻后,混合气体的密度不变 B.该反应的平衡常数表达式 C.由T1向T2变化时,V正 > V逆 D.此反应的正反应为放热反应
|
|
| 22. | 详细信息 | |||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(Ⅰ)某化学兴趣小组要完成中和热的测定.回答下列问题: (1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L﹣1盐酸、0.55mol•L﹣1NaOH溶液,实验尚缺少的玻璃用品是_______. (2)已知:反应后溶液的比热容c为4.18J·℃﹣1•g﹣1,0.5mol•L﹣1盐酸和0.55mol·L﹣1NaOH溶液的密度均为1g·cm﹣3.实验时记录的实验数据如下:
①盐酸和氢氧化钠反应的中和热△H1=____________(保留两位小数) ②已知:CH3COOH(aq) CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) △H3 则△H3_____△H1(填“>”、“<”、“=”) (Ⅱ)某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。该小组实验方案如下(实验测定KMnO4溶液完全褪色时间)。回答下列问题:
(3)上述反应的离子方程式为______________________________________ (4)t1_____ t2(填“>”、“<”、“=”),其理由是__________________ (5)实验②和实验③两组实验的目的是______________________________ (6)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出下列猜想: 猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。 猜想②:__________________(请你补充) 要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是______。 A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 23. | 详细信息 | ||||||||||||||
|
A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
回答下列问题: (1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子 (2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示). (3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______ (4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________ A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构 C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏 (5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________ (6) 向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________ A.配位键 B.极性共价键 C.非极性共价键 D.离子键
|
|||||||||||||||
| 24. | 详细信息 |
|
硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。 (1)基态锌原子的价电子排布式是_____________。 (2)根据元素周期律,电负性Se______S,第一电离能Se________As(填“>”或“<”)。 (3)H2Se的分子构型是___________,其中Se的杂化轨道类型是___________。 (4)H2O的沸点______________(填“>”或“<”)H2Se的沸点,其原因是:______。 (5)晶体Zn为六方最密堆积,其配位数是_______________。 (6)在硒化锌ZnSe晶胞中,Se2—离子作面心立方最密堆积,且Se2—与Se2—之间的最短距离为a nm,则晶胞边长为_____________ nm。 (7)假设阿伏伽德罗常数值为NA,则144g 硒化锌ZnSe晶体中的晶胞数是__________。
|
|
| 25. | 详细信息 |
|
Ⅰ.已知:CO2(g)+ 3H2(g) 现在体积为1L的密闭容器中,充入CO2和H2。实验测得反应体系中物质的物质的量与时间关系如下表,
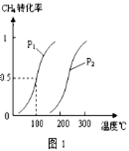
回答下列问题: (1)表格中的n1=______________ (2)0-5min内 v (H2)=_______________ (3)该条件下CO2的平衡转化率为__________________ Ⅱ.在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g)。一定条件下发生反应:CH4(g)+H2O(g) 已知CH4的转化率与温度、压强的关系如图1所示。回答下列问题:
(4)100℃时平衡常数为_________________. (5)图1中的p1_______p2(填“<”、“>”或“=”),其理由是:_________________ (6)若100℃时该可逆反应的平衡常数是K1,200℃该该可逆反应的平衡常数是K2,则K1___ K2(填“<”、“>”或“=”).其理由是_____________________________________________
|
|