2017陕西高二上学期人教版高中化学期中考试
| 1. | 详细信息 |
|
化学平衡主要研究下列哪一类反应的规律( ) A.可逆反应 B.任何反应 C部分反应 D.气体反应
|
|
| 2. | 详细信息 |
|
在密闭容器中于一定条件下进行下列反应:2SO2 + O2 A.SO2 、O2 B.SO2 、SO3 C.SO2 、O2 、SO3 D.O2 、SO3
|
|
| 3. | 详细信息 |
|
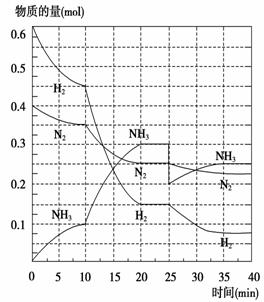
氨是重要的氮肥,合成原理为:N2(g)+3H2(g) ΔH=-92.4 kJ/mol。回答下列问题:
(2)在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图所示,回答下列问题: ①(1分)10 min内以NH3表示的平均反应速率:______。 ②(2分)在10~20 min内:NH3浓度变化的原因可能是( ) A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量 ③(每空1分)第1次达到平衡的 ④(共3分)在反应进行至25 min时,曲线发生变化的原因( ) A.缩小容器体积 B.降低温度 C.分离了部分NH3 达第二次平衡时,新平衡的平衡常数K2 K1,(填“大于”、“小于”或“等于”)。
|
|
| 4. | 详细信息 |
|
下列不属于自发进行的变化是( ) A.红墨水加到清水使整杯水变红 B.冰在室温下融化成水 C.水电解生成氢气和氧气 D.铁器在潮湿的空气中生锈
|
|
| 5. | 详细信息 |
|
不同情况下测得A(g)+3B(g) A.υ(D)=0.4 mol·L—1·s—1 C.υ(B)=0.6 mol·L—1·s—1 D.υ(A)=0.15 mol·L—1·s—1
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) A.反应条件是加热的反应都是吸热反应 B.化学反应除了生成新的物质外,通常放出大量热 C.物质燃烧一定是放热反应 D.放热的化学反应不需要加热就能发生
|
|
| 7. | 详细信息 |
|
一定能使反应速率加快的因素是( ) ①扩大容器的容积 ②使用催化剂 ③增加反应物的质量 ④升高温度 ⑤缩小容积 A.②③ B.②③④ C.②③④⑤ D.④
|
|
| 8. | 详细信息 |
|
下列各电离方程式中,书写正确的是( ) A.CH3COOH C.Al(OH)3===Al3++3OH- D.NaH2PO4
|
|
| 9. | 详细信息 | ||||||||||||||||||||
|
下表中物质的分类组合完全正确的是( )
|
|||||||||||||||||||||
| 10. | 详细信息 |
|
在一定温度下,A(气)+3B(气) A.单位时间内减少x mol A,同时减少3xmolB B.反应不再进行 C.当n(A)∶n(B)∶n(C)=1∶3∶2时 D.混合体系的平均相对分子质量不再改变
|
|
| 11. | 详细信息 |
|
已知反应:①101kPa时,2C(s)+O2(g ②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol 下列结论错误的是( ) A.碳的燃烧热大于110.5 kJ/mol B.①的反应热为221 kJ C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
|
|
| 12. | 详细信息 |
|
一定条件下,密闭容器中进行如下反应:NO(g)+CO(g) A加催化剂同时升高温度 B 加催化剂同时增大压强 C升高温度同时充入N2 D 降低温度同时增大压强
|
|
| 13. | 详细信息 |
|
若1体积硫酸恰好与10体积p A.10∶1 B.5∶1 C.1∶1 D.1∶10
|
|
| 14. | 详细信息 |
|
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 D.加入少量CH3COONa固体,平衡向正反应方向移动
|
|
| 15. | 详细信息 |
|
密闭容器中发生如下反应:mA(g)+nB(g) A.m+n>p B.平衡向逆反应方向移动 C.A的转化率降低 D.C的体积分数减小
|
|
| 16. | 详细信息 |
|
在密闭容器中进行下列反应:M(g)+N(g)
A. 正反应放热,L是固体或液体 B. 正反应放热,L是气体 D. 正反应吸热,L是气体
|
|
| 17. | 详细信息 |
|
将纯水加热至较高温度,下列叙述正确的是( ) A 水的离子积变大、pH变小、呈酸性 B 水的离了积不变、pH不变、呈中性 C水的离子积变小
|
|
| 18. | 详细信息 |
|
已知HClO的酸性比H2CO3弱,反应Cl2+H2O A.光照 B.加入石灰石 C.加入固体NaOH D.加水
|
|
| 19. | 详细信息 |
|
如图,横坐标表示加水量,纵坐标表
|
|
| 20. | 详细信息 |
|
在25℃时,用蒸馏水稀释1 mol/L的醋酸溶液至0.01 mol/L,随 A.
|
|
| 21. | 详细信息 |
|
室温下,在pH=11的某溶液中,由水电离的c(OH-)为( ) ①1.0×10-7 mol·L-1 ②1.0×10-6 mol·L-1 ③1.0×10-3 mol·L-1 ④1.0×10-11 mol·L-1 A.③ B.④ C.①或③ D.③或④
|
|
| 22. | 详细信息 |
|
反应3Fe(s)+4H2O(g) (1)增加Fe的量,其反应速率________ (2)将容器的体积缩小一半,其反应速率____________。 (3)保持体积不变,充入N2使体系压强增大,其反应速率____________。 (4)保持压强不变,充入N2使容器的体积增大,其反应速率____________。
|
|
| 23. | 详细信息 |
|
在一定温度下有:①盐酸②醋酸两种酸 (用序号来回答)。 (1)当其物质的量浓度相同时,c(H+)由大到小的顺序是____________。 (2)同体积、同物质的量浓度的两种酸溶液,中和NaOH的量由大到小的顺序是_________。 (3)当c(H+)相同时,物质的量浓度由大到小的顺序为___________。 (4)当c(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为________________。 (5)将c(H+)相同的两种酸均加水稀释至原来的100倍后,c(H+) 由大到小的顺序为___________。
|
|
| 24. | 详细信息 | |||||||||||||||||||||||
|
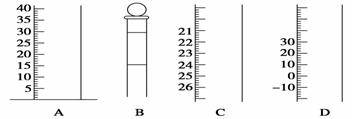
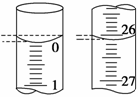
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填空。 (1)(每空1分)如下图是常见仪器的部分结构。
①写出仪器名称B C ②使用前需检查是否漏水的仪器有 。 (2)(每空1 (3)(2分)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( ) A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 (4)(1分)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为________mL。 (5)(2分)某学生根据3次实验分别记录有关数据如表:
依据上表数据列式计算该NaOH溶液的物质的量浓度___________。(保留两位有效数字)
|
||||||||||||||||||||||||