2019广东高一下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
.18O常用作“示踪原子”,下列关于18O的说法正确的是 A. 中子数为8 B. 核外电子数为6 C. 质子数为18 D. 与16O互为同位素
|
|
| 2. | 详细信息 |
|
下列化学用语正确的是 A. 镁离子:Mg2+ B. 氯原子:Cl2 C. S原子的结构示意图:
|
|
| 3. | 详细信息 |
|
依据元素的原子结构和性质的变化规律,推断下列元素金属性最强的是 A. Na B. O C. Al D. S
|
|
| 4. | 详细信息 |
|
下列过程需用萃取操作的是 A. 压榨花生获取油脂 B. 油和水的分离 C. 用CCl4提取水中溶解的I2 D. 除去粗盐中的杂质
|
|
| 5. | 详细信息 |
|
下列反应属于取代反应的是 A. 苯燃烧生成CO2和H20 B. 乙烯使Br2的CCl4溶液褪色 C. 苯与液溴的反应 D. 乙醇使酸性KMn04溶液褪色
|
|
| 6. | 详细信息 |
|
在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的下列叙述不正确的是
A. 碳棒上有气体放出,溶液pH变大 B. a是正极,b是负极 C. 导线中有电子流动,电子从a极到b极 D. a极上发生了氧化反应
|
|
| 7. | 详细信息 |
|
下列措施中,不能提高化学反应速率的是 A. Zn与稀硫酸的反应中,用Zn片代替Zn粉 B. KC103的分解反应中,适当提高反应温度 C. H202的分解反应中,添加适量MnO2 D. 合成氨的反应中,增大体系的总压力
|
|
| 8. | 详细信息 | ||||||||||||
|
某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1 C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
|
|||||||||||||
| 9. | 详细信息 |
|
乙醇在生活中用途较多,下列关于乙醇的说法正确的是 A. 能与Na反应 B. 是食醋的主要成分 C. 能使红色石蕊试纸变蓝 D. 能与饱和Na2CO3溶液反应产生H2
|
|
| 10. | 详细信息 |
|
一种天然气臭味添加剂的绿色合成方法为:CH3CH2CH=CH2+H2S A. 乙烯与水反应制备乙醇 B. 苯和硝酸反应制备硝基苯 C. 乙酸与乙醇反应制备乙酸乙酯 D. 甲烷与Cl2反应制备一氯甲烷
|
|
| 11. | 详细信息 |
|
下列化合物互为同分异构体的是 A. 乙醇与乙酸 B. 乙烯与聚乙烯 C. 葡萄糖与果糖(C6H1206) D. 蛋白质与氨基酸
|
|
| 12. | 详细信息 | ||||||
|
元素周期表是学习和研究化学的重要工具。短周期元素甲~戊在元素周期表中的相对位置如表所示,下列判断正确的是
A. 原子半径:丙>甲 B. 原子核外电子层数:戊<丁 C. 原子核外最外层电子数:丙>戊>丁 D. 元素的最高价氧化物的水化物的酸性:戊<丁
|
|||||||
| 13. | 详细信息 |
|
人类使用金属材料历史悠久。下列说法不正确的是 A. 电解NaCl溶液制备Na B. 电解熔融MgCl2制备Mg C. 钢体船外镇嵌锌板可起防腐作用 D. 青铜器的材质属于含锡合金
|
|
| 14. | 详细信息 | |||||||||||||||
|
下列选项中,物质与其特征反应对应正确的是
A. A B. B C. C D. D
|
||||||||||||||||
| 15. | 详细信息 |
|
某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是 A. R一定是第VIIA族元素 B. R的最高价氧化物为RO3 C. R的气态氢化物能燃烧 D. R的气态氢化物易溶于水显碱性
|
|
| 16. | 详细信息 |
|
aXn-和bYm+为两主族元素的离子,它们的电子层结构相同, 下列判断错误的是 A. 原子半径X<Y B. a+n=b-m C. Y最高价氧化物的化学式为YOm D. X的氢化物的化学式为HnX
|
|
| 17. | 详细信息 |
|
一定温度下,某容器内发生反应N2(g)+3H2(g) A. 氨气、氮气、氢气 C. 氨气、氮气、氢气的浓度不变 D. 恒温恒容时,混合气体的密度保持不变
|
|
| 18. | 详细信息 |
|
下列说法正确的是 A. 实验室鉴别丙烯和苯,可以用酸性高锰酸钾溶液 B. 甲烷、乙烯和苯都可以与溴水发生反应 C. 乙醇被氧化只能生成乙醛 D. 乙醇和乙酸生成乙酸乙酯的反应不属于取代反应
|
|
| 19. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下表是元素周期表中的一部分,回答下列问题:
(1)写出下列元素名称①_______,⑤_______,⑨_______,⑾________。 (2)在这些元素中,金属性最强的元素是_______;除稀有气体元素以外的元素中原子半径最大的是_______,原子半径最小的是______。其氢化物最稳定的是____。(填写元素符号) (3)元素②和③形成的离子的电子层结构_________(填“相同”或“不相同”),两者形成的化合物是否是离子化合物________(填“是”或“否”),该化合物的电子式为______________。 (4)元素⑧ (5)在这些元素的最高价氧化物对应的水化物中,属于两性氢氧化物的是_________(填写化学式),写出其和盐酸反应的化学方程式__________________________________________。
|
|||||||||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
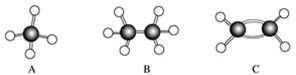
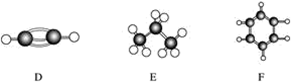
.A~F是几种烃分子的球棍模型(如下图),据此回答下列问题:
(1)属于同系物的是________; (2)常温下含碳量最高的气态烃的分子式是____________________________________; (3)能够发生加成反应的烃有(填数字)________种; (4)写出C与溴的四氯化碳溶液反应的化学方程式________________; (5)写出F与溴发生取代反应的化学方程式___________________________。
|
|
| 21. | 详细信息 |
|
(I)利用反应CuSO4+Fe===Cu+FeSO4可设计为原电池。 (1)负极材料是________(写名称),电极反应为__________________________________。 (2)正极电极反应式为______________________。 (3)溶液中SO42-向________极移动。 (II)工业合成氨反应:N2+3H2 (4)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总理论数值,其原因是____________________________。 (5)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。 (6)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。 a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0 c.反应达到最大限度 d.N2和H2的浓度相等 e.生成1 mol N2的同时,消耗2 mol NH3 f.生成3 mol H2的同时,生成2 mol NH3
|
|
 D. 乙醇的结构式:CH3CH2OH
D. 乙醇的结构式:CH3CH2OH