鲁科版选择性必修1 第1章 化学反应与能量转化 章末综合检测卷
| 1. 选择题 | 详细信息 |
|
下列关于能量变化的说法正确的是 A. “冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 B. 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 C. 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定 D. 化学反应遵循质量守恒的同时,也遵循能量守恒 |
|
| 2. 选择题 | 详细信息 | |||||||||||||||
下列实验装置符合实验目的是( )
|
||||||||||||||||
| 3. 选择题 | 详细信息 |
|
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是( ) A. Z>Y>W>X B. Y>Z>W>X C. W>Z>Y>X D. X>Y>Z>W |
|
| 4. 选择题 | 详细信息 |
|
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3 kJ·mol-1。分别向1 L 0.5 mol·L-1的NaOH溶液中加入:①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的ΔH的绝对值分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是( ) A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH3<ΔH1 C.ΔH1=ΔH2=ΔH3 D.ΔH2>ΔH3>ΔH1 |
|
| 5. 选择题 | 详细信息 |
将图所示装置中的盐桥(琼脂-饱和 A.装置Ⅰ中,电路转移 B.装置Ⅰ中的石墨电极与装置Ⅱ中的石墨a电极的电极反应式相同 C.两装置均是将化学能转化为电能 D.装置Ⅱ中电子流向为 |
|
| 6. 选择题 | 详细信息 |
|
已知下列反应: ① ② ③ 则 A. B. C. D. |
|
| 7. 选择题 | 详细信息 |
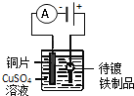
下列关于图所示的四个实验装置的说法正确的是( )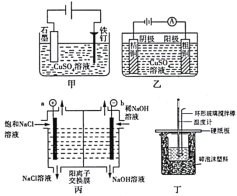 A.装置甲能防止铁钉生锈 B.装置乙为电镀铜装置 C.装置丙中阳离子交换膜能避免氯气与碱反应,且b端产生的气体能使湿润的淀粉碘化钾试纸变蓝 D.装置丁能测定中和反应的反应热 |
|
| 8. 选择题 | 详细信息 |
氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是( ) A.b极附近溶液的 B.a极的电极反应为 C.该法制备 D.当电路中通过 |
|
| 9. 选择题 | 详细信息 |
为探究金属的腐蚀情况,某同学将锌片和铜片置于浸有饱和食盐水和酚酞的滤纸上,并构成如图所示的装置。下列判断合理的是( )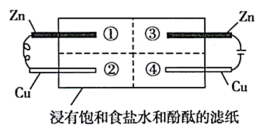 A.左边铜片上有气泡冒出 B.右边锌片上的反应为 C.最先观察到红色的区域是② D.两铜片质量均不发生变化 |
|
| 10. 选择题 | 详细信息 |
如图所示的电化学装置电极Ⅰ为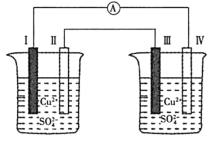 A.电子流动方向:电极Ⅳ→电流表→电极Ⅰ B.电极Ⅰ的电极反应: C.电极Ⅱ发生氧化反应 D.右池中的 |
|
| 11. 选择题 | 详细信息 |
|
工业上电解 A.阴极电极反应式为 B.阳极反应中S的化合价升高 C. D.可以用铜电极作阳极 |
|
| 12. 选择题 | 详细信息 |
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )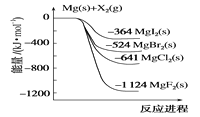 A.由MgCl2制取Mg是放热过程 B.热稳定性:MgI2>MgBr2>MgCl2>MgF2 C.金属镁和卤素单质(X2)的反应都是放热反应 D.由图可知,此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为MgBr2(s)+Cl2(g)→MgCl2(s)+Br2(g)-117kJ |
|
| 13. 选择题 | 详细信息 |
液流电池具有容量高、使用领域广、循环使用寿命长的特点,是一种新型蓄电池。如图所示是一种液流电池工作原理图。电池工作时,下列叙述错误的是( )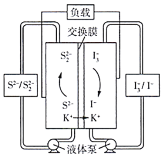 A.负极反应: B.交换膜为阳离子交换膜 C.左室中 D.电池总反应: |
|
| 14. 选择题 | 详细信息 |
利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、 A.反应①②③④均在正极发生 B.④的电极反应式为 C.单位时间内,三氯乙烯脱去amolCl时ne=amol D.增大单位体积水体中小微粒ZVI的投入量,可使nt增大 |
|
| 15. 选择题 | 详细信息 |
利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是 A.在光伏电池中a极为正极 B.石墨(2)极附近溶液的pH降低 C.HR溶液:c2<c1 D.若两极共收集3mol气体,则理论上转移4mol电子 |
|
| 16. 填空题 | 详细信息 |
|
已知下列一组热化学方程式: ① ② ③ ④ ⑤ ⑥ 回答下列问题: (1)上述反应中属于吸热反应的是______(填序号)。 (2)上述放热反应中,相同物质的量的非氧气物质参加反应,放出的热量从大到小的顺序是_____(用序号表示)。 (3) |
|
| 17. 实验题 | 详细信息 |
|
高铁酸钾 回答下列问题: 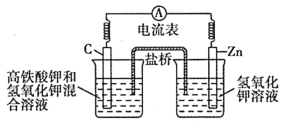 (1)该电池放电时正极的电极反应式为___________________。放电过程中负极附近溶液的 (2)图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有__________________。 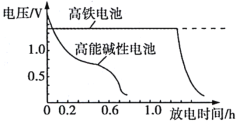 (3)高铁酸钾 |
|
| 18. 填空题 | 详细信息 |
如下图装置中,b电极用金属 M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡。试回答: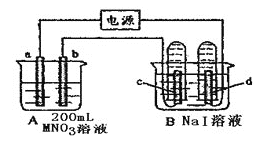 (1)a为__________极,c极的电极反应式为_________________。 (2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:__________,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为_________________。 (3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了_____moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为_____________。 |
|
| 19. 实验题 | 详细信息 |
|
为节省药品和时间,甲、乙、丙三位同学选用铜片、锌片、稀硫酸、 试回答下列问题: (1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,可以观察到的现象是___________。甲同学的设计思路是__________________。 (2)乙同学接着甲同学的实验,向烧杯中滴加________溶液,进而观察到的现象是____________。乙同学比较锌、铜的金属活动性相对强弱所依据的原理是________________________________________。 (3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂(作为电解液)。反应在调控下随即开始,反应的化学方程式为__________________,可观察到的实验现象是_________________________。 (4)再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌和铜的金属活动性的相对强弱(简要说明操作和现象):__________________________________。 |
|
| 20. 填空题 | 详细信息 |
|
铝作为一种应用广泛的金属,在电化学领域发挥着举足轻重的作用。回答下列问题: (1)某同学根据氧化还原反应:  ①电极X的化学式为__________,电极Y的化学式为________________。 ②盐桥中的阴离子向_____(填化学式)溶液中移动。 (2)新型电池中的铝电池类型较多。 ① ② ③图为  |
|
高中化学 试卷推荐
- 高中化学人教版 必修1 第三章 金属及其化合物 3.用途广泛的金属材料 用途广泛的金属材料
- 2017-2018年高一上学期期中考试化学考试题(湖南省衡阳县四中)
- 2017-2018年高一上学期第二次月考化学考卷带参考答案和解析(贵州省遵义市第四中学)
- 2017-2018年高二12月月考化学试卷(山东省寿光市第一中学)
- 2018年至2019年高二上学期第一次月考化学试卷带参考答案和解析(宁夏回族自治区育才中学)
- 2017-2018年高一12月月考化学试卷(江苏省泰州中学)
- 高中化学人教版 选修三 第2章 分子结构与性质 键参数--键能、键长与键角
- 邻水实验学校高一化学月考测验(2019年上期)免费试卷完整版
最近更新