2019黑龙江高三上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
关于一些重要的化学概念有下列说法,其中正确的是 ①Fe(OH)3胶体和CuSO4溶液都是混合物 ②BaSO4是一种难溶于水的强电解质 ③冰醋酸、纯碱、小苏打分别属于酸、碱、盐 ④煤的干馏、煤的汽化和液化都属于化学变化 A.①② B.①②④ C.②③④ D.③④
|
|
| 2. | 详细信息 |
|
下列应用不涉及物质氧化性或还原性的是 A.用葡萄糖制镜或保温瓶胆 B.用ClO2杀菌、消毒 C.用Na2SiO3溶液制备木材防火剂 D.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
|
|
| 3. | 详细信息 |
|
阿伏加德罗常数的值为NA。下列说法不正确的是 A.1LpH=3的盐酸与1LPH=3的CH3COOH溶液中,水电离出的H+数目均为10-11NA B.0.1mol乙烯与乙醇的混合物中含碳原子数为0.2 NA C.标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA D.0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数小于0.2mol
|
|
| 4. | 详细信息 |
|
正确表示下列反应离子方程式是 A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ C.硫酸铵溶液和氢氧化钡溶液反应:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2 NH3·H2O D.FeCl2溶液中加入稀硝酸: 4H++NO3-+Fe2+=Fe3++NO↑+2H2O
|
|
| 5. | 详细信息 |
|
NA代表阿伏加德罗常数的值。下列说法正确的是 A.常温常压下,124 g P4中所含P-P键数目为4NA B.常温下1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA C.64 g SO2含有氧原子数为2NA D.标准状况下,22.4L H2O含有的分子数为NA
|
|
| 6. | 详细信息 |
|
下列有关铁、铝及其化合物的说法中不正确的是 A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 C.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 D.氯化铁溶液有较强氧化性,故可用作净水剂
|
|
| 7. | 详细信息 |
|
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是 A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1 B.在NF3与H2O的反应中,H2O作还原剂 C.若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol D.NF3在空气中一旦泄漏,不易于发现
|
|
| 8. | 详细信息 | ||||||||||||||||||||
|
下列实验操作、现象和结论均正确的是
|
|||||||||||||||||||||
| 9. | 详细信息 |
|
下列有关热化学方程式的叙述正确的是 A.已知甲烷的燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=890.3 kJ/mol B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 C.已知中和热为ΔH=-57.3 kJ/mol,则1 mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热 D.已知S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2
|
|
| 10. | 详细信息 |
|
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是 A.X与其他三种元素均可形成两种或两种以上的二元化合物 B.Y与其他三种元素分别形成的化合物中只含有离子键 C.四种元素的简单离子具有相同的电子层结构 D.W的氧化物对应的水化物均为强酸
|
|
| 11. | 详细信息 |
|
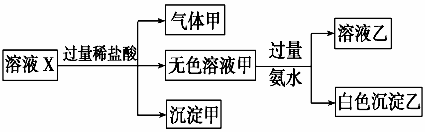
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是
A.气体甲一定是纯净物 B.沉淀甲是硅酸和硅酸镁的混合物 C.K+、AlO2-和SiO32-一定存在于溶液X中 D.CO32-和SO42-一定不存在于溶液X中
|
|
| 12. | 详细信息 |
|
对实验Ⅰ~Ⅳ的实验现象预测正确的是
A.实验Ⅰ:液体分层,下层呈无色 B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解 C.实验Ⅲ:试管中有红色沉淀生成 D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
|
|
| 13. | 详细信息 | |||||||||||||||
|
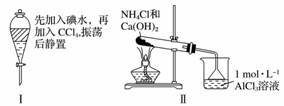
完成下列实验,所选装置正确的是
|
||||||||||||||||
| 14. | 详细信息 |
|
恒温、恒压下,将1mol O2和2mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2+O2
A.40% B.60% C.80% D.90%
|
|
| 15. | 详细信息 |
|
在一定温度下的恒压容器中,进行可逆反应A(g)+B(g)⇌C(g)+2D(g);下列能说明该反应达到平衡状态的是 ①反应混合物的密度不再改变 ②混合气体的平均相对分子质量不再改变 ③C和D的物质的量之比为1:2 ④体系压强不再改变 ⑤C的质量分数不再改变 ⑥v(A):v(C)=1:1. A.①②④⑤ B.①②⑤ C.②⑤⑥ D.①②③④⑤⑥
|
|
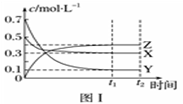
| 16. | 详细信息 |
|
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是
A.该反应的热化学方程式为X(g)+3Y(g) B.若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大 C.温度分别为T1和T2时的平衡常数大小关系为K2>K1 D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
|
|
| 17. | 详细信息 |
|
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g) A.平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1 B.平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大 C.若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大 D.平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
|
|
| 18. | 详细信息 |
|
下列有关水电离情况的说法正确的是 A.25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同 B.其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小 C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小 D.其它条件不变,温度升高,水的电离程度增大,Kw 增大
|
|
| 19. | 详细信息 |
|
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr A.加入NaOH,可增大乙醇的物质的量 B.增大HBr浓度,有利于生成C2H5Br C.若反应物增大至2 mol,则两种反应物平衡转化率之比不变 D.若起始温度提高至60℃,可缩短反应达到平衡的时间
|
|
| 20. | 详细信息 |
|
一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s) A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变 B.将体积增大为原来的2倍,再次达到平衡时,气体的密度变大 C.因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以该分解反应ΔH<0 D.保持容器压强不变,充入He,平衡向逆反应方向进行
|
|
| 21. | 详细信息 |
|
已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 A.该溶液的pH=4 B.升高温度,溶液的pH增大 C.此酸的电离常数约为1×10-7 D.稀释HA溶液时,不是所有粒子浓度都一定会减小
|
|
| 22. | 详细信息 | ||||||||
|
部分弱电解质的电离常数如下表:
下列说法错误的是 A.结合H+的能力:CO32->CN->HCO3->HCOO- B.2CN-+H2O+CO2=2HCN+CO32- C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 D.25 ℃时,反应HCOOH + CN-
|
|||||||||
| 23. | 详细信息 |
|
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是 A.由水电离的c(H+):①=②>③=④ B.将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:③>② C.等体积的①、②溶液分别与足量铝粉反应,生成H2的速率:①>② D.向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
|
|
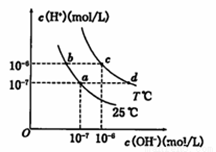
| 24. | 详细信息 |
|
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
A.向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-) B.25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化 C.T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 D.b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
|
|
| 25. | 详细信息 |
|
常温下列各组离子在指定溶液中能大量共存的是 A.无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl- B.c(H+)/c(OH-) =1×10-12的溶液中:K+、Na+、CO32-、NO3- C.c(Fe2+)=1 mol•L-1的溶液中:K+、NH4+、MnO4-、SO42- D.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
|
|
| 26. | 详细信息 |
|
铁、钴(Co)、镍(Ni)是同族元素,主要化合价均为+2、+3价,都是较活泼的金属,它们的化合物在工业上有重要的应用. (1)配制FeSO4溶液时,需加入稀硫酸,其目的是_________________________ (2)写出CoCl2与氯水反应的化学方程式______________________________ (3) Co2+和Fe3+均可与KSCN溶液发生相似的反应,向CoCl2溶液中加入KSCN溶液,生成某种蓝色离子,该离子中钴元素的质量分数约为20%。则该离子的化学式为__________________。 (4)碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS,从镍矿渣出发制备碳酸镍的反应如下: 先向镍矿渣中加入稀硫酸和NaClO3浸取出Ni2+,反应的离子方程式有①_____________________②NiS+ ClO3-+H+-Ni2++S+Cl-+H2O(未配平),此反应中还原产物与氧化产物的物质的量比为_________。再加入Na2CO3溶液沉镍,即制得碳酸镍,检验Ni2+是否沉淀完全的方法_____________________________________
|
|
| 27. | 详细信息 |
|
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体。Q和X形成的离子化合物XQ是碱石灰的主要成分。X、Y、Z位于同一周期,Y的外围电子数是最外层电子数的6倍,Z位于ds区且不能和稀硫酸反应生成H2。请回答下列问题: (1)Q的价层电子排布式为_______________________,L的含氧酸HLO3中L的杂化方式为__________________,酸根LO3-的离子构型为____________________。 (2)ZR42-的配体是__________,在ZSO4溶液中加入过量KCN,生成配合物[Z(CN)4]2-,则1mol该配合物中含有的π键的数目是_______________。与Z同周期的元素中,与Z原子最外层电子数相等的元素还有_____________(填元素符号) (3)Y的氧化物呈如下图所示的无限链状结构,则该氧化物的化学式为______________。
(4)X和Z的晶体堆积模型相同,配位数为______________,已知X原子半径约为200pm,则晶体X的密度为__________________g/cm3(计算结果保留两位有效数字)。 (5)XL2晶体含有层状结构,其层内有强极性共价键,层间以范德华力相连接,则XL2的晶体类型是___________。
|
|
| 28. | 详细信息 |
|
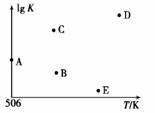
以天然气为原料合成甲醇。有关热化学方程式如下: ①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1 ②CO(g)+2H2(g) ③2CH4(g)+O2(g) (1)ΔH2=____kJ·mol-1。 (2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号) A.正反应速率先增大后减少 B.化学平衡常数K减少 C.再加入一定量碳 D.反应物气体体积分数增大 (3)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应: CO(g)+2H2(g)
①该反应自发进行的条件是 _____________(填“低温”、“高温”或“任意温度”) ②506 K时,反应平衡时H2的转化率为___;压强:p1_____(填“>”“<”或“=”) p2。 ③反应速率:N点v正(CO)____(填“>”“<”或“=”)M点v逆(CO)。 ④若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图所示。则温度为506 K时,平衡常数K=____________(保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为________________________。
(4)在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________________。
|
|
| 29. | 详细信息 | ||||||||||||
|
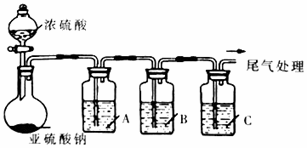
葡萄酒常用Na2S2O5作抗氧化剂。中华人民共和国国家标准(G112760-2011)规定葡萄酒中抗氧化剂的残留量(以游离SO2计算)不能超过0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,并收集某葡萄酒中SO2,对其含量进行测定。(夹持仪器省略)
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等. ①请完成下列表格
②A中发生反应的离子方程式为______________________________________ (2)该小组收集某300.00mL葡萄酒中SO2,然后用0.0900 mol/L NaOH标准溶液进行滴定,滴定前排气泡时,应选择下图中的___________________(填序号);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处时,管内液体的体积____________________(填序号)(①= 10mL;②=40mL; ③<10mL;④>40mL)
(3)该小组在实验室中先配制0.0900 mol/L NaOH标准溶液,然后再用其进行滴定。下列操作会导致测定结果偏高的是________。 A.未用NaOH标准溶液润洗滴定管 B.滴定前锥形瓶内有少量水 C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 D.配制溶液定容时,俯视刻度线 E.中和滴定时,观察标准液体积读数时,滴定前仰视,滴定后俯视 (4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为_______g/L。
|
|||||||||||||
| 30. | 详细信息 |
|
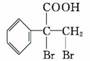
香料甲和G都在生活中有很多用途,其合成路线如下:
已知:①R1-CHO+R2-CH2-CHO ②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。 (1)A的名称是____,G中含氧官能团的名称是____。 (2)②的反应类型是____,B和F的结构简式分别为______、______。 (3)写出一种能鉴别A和D的试剂:______;C有多种同分异构体,其中属于芳香族化合物的有____种。 (4)写出反应①的化学方程式:_____________。 (5)G的同分异构体
|
|