2019新疆高一下学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
简单原子的原子结构可用下图形象地表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是( ) a.①②③互为同位素 b.①②③互为同素异形体 c.①②③是三种化学性质不同的粒子 d.①②③具有相同的质量数 e.①②③具有相同的质量 f.①②③是三种不同的原子 A.a、f B.d、e C.b、c D.e、f
|
|
| 2. | 详细信息 |
|
下列各组物质中,化学键类型都相同的是( ) A. CaCl2和NaOH B. Na2O和Na2O2 C. CO2和CS2 D. HCl和NaOH
|
|
| 3. | 详细信息 |
|
下列有关化学用语使用正确的是 A. 硫离子的原子结构示意图 B. NH4Cl的电子式: C. 原子核内有10个中子的氧原子: D. 二氧化碳的结构简式 O-C-O
|
|
| 4. | 详细信息 |
|
下列能源中属于一次能源的是 A.汽油 B.锂电池 C.氢能 D.煤
|
|
| 5. | 详细信息 |
|
化学反应一般均会伴随着能量变化,对H2在O2中燃烧的反应,正确的是 A.该反应为吸热反应 B.该反应为放热反应 C.断裂H-H键放出能量 D. 生成H-O键吸收能量
|
|
| 6. | 详细信息 |
|
下列关于物质结构、性质的说法正确的是 A. 因为酸性:HCl>H2CO3,所以非金属性:Cl>C B. 同一周期元素的原子,半径越小越容易失去电子 C. K的原子半径比Na的原子半径大,K与水反应比Na与水反应更剧烈 D. 离子化合物中可能含有共价键,共价化合物中可能含有离子键
|
|
| 7. | 详细信息 |
|
下列叙述正确的是( ) A.含有离子键的化合物不可能含有非极性键 B. 非极性键可能存在单质中,也可能存在化合物中 C. 盐酸中含有H+和Cl-,故HCl为离子化合物 D. 含有共价键的化合物不可能是离子化合物
|
|
| 8. | 详细信息 |
|
下列分子中所有原子都满足最外层为8电子稳定结构的是 A. H2O B. CO2 C. PCl5 D. BF3
|
|
| 9. | 详细信息 |
|
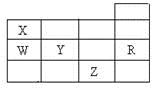
右表为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述中,正确的是( )
A. 常温下,Z单质为气态物质 B. Y、Z的阴离子电子层结构都与R原子的相同 C. W的氢化物的稳定性要比X的氢化物的稳定性强 D. Y元素的非金属性比W元素的非金属性强
|
|
| 10. | 详细信息 |
|
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( ) A. 原子半径的大小顺序: Y<Z<W<X B. 化合物YX、ZX2、WX3中化学键的类型相同 C. 非金属性的强弱顺序:X>W>Z D. 元素W的最高价氧化物对应水化物的酸性比Z的弱
|
|
| 11. | 详细信息 |
|
下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是 A. NH4Cl+NaOH=NaCl+NH3↑+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3↑ C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=4NaOH+O2↑
|
|
| 12. | 详细信息 |
|
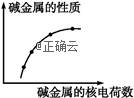
如图表示第ⅠA族金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是
A. 金属性 B. 与水反应的剧烈程度 C. 阳离子的氧化性 D. 原子半径
|
|
| 13. | 详细信息 |
|
1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g) A.放热反应 B. 吸热反应 C.化合反应 D.可逆反应
|
|
| 14. | 详细信息 |
|
将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) A. 用物质B表示2s内的平均反应速率为0.15 mol/(L·s) B. 用物质A表示2 s内的平均反应速率为0.3 mol/(L·s) C.2 s后物质B的浓度为0.35 mol/L D. 2 s后物质A的转化率为30%
|
|
| 15. | 详细信息 |
|
对于反应A (g)+ 3B(g) =" 2C(g)" + 2D(g),下列数据表示反应进行得最快的是( ) A. v(A)=0.7mol/(L·s) B. v (B) ="1.8mol/(L" · s) C. v (C)=1mol/(L·s) D. v (D) =1.6mol/(L·min)
|
|
| 16. | 详细信息 |
|
上海自主研发了一种氢燃料汽车。它是以30%KOH溶液为电解质的氢氧燃料电池,下列有关说法中,不正确的是( )。 A.正极反应:O2 + 2H2O + 4e- === 4OH- B.当正极消耗22.4 L H2时,负极11.2 L O2消耗(相同条件) C. 发生氧化反应的是负极 D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
|
|
| 17. | 详细信息 |
|
已知某反应的各物质浓度数据如下: aA(g)+bB(g) 起始浓度(mol·L-1) 3.0 1.0 0 2 s末浓度(mol·L-1) 1.8 0.6 0.8 据此可推算出上述反应化学方程式中,各物质的化学计量数之比是 ( )。 A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
|
|
| 18. | 详细信息 |
|
在一定温度下,反应A2(g) + B2(g) A、单位时间内生成nmolA2同时生成nmolAB B、容器内的总物质的量不随时间变化 C、单位时间内生成2nmolAB的同时生成nmolB2 D、单位时间内生成nmolA2的同时生成nmolB2
|
|
| 19. | 详细信息 |
|
近来,科学家研制了一种新型的乙醇电池,它用磺酸类质子作溶剂,在2000C左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为:C2H5OH+3O2→2CO2+3H2下列说法不正确的是 A.C2H5OH在电池的负极上参加反应 B.在外电路中电子由负极沿导线流向正极 C.1mol乙醇被氧化转移6mol电子 D.电解质溶液中阳离子移向正极,阴离子移向负极
|
|
| 20. | 详细信息 |
|
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同。下列说法不正确的是 A. 离子半径:X+> Y3+> Z2- B. 碱性:XOH > Y(OH)3 C. 单质的还原性:X > Y D. 原子序数:Y > X > Z
|
|
| 21. | 详细信息 | ||||||||||||
|
某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大___________,原因是___________________________________________________。 (2)哪一时间段的反应速率最小___________,原因是_____________________。 (3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变) ___________。 (4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水、B.NaCl溶液、C.NaNO3溶液、D.CuSO4溶液、E.Na2CO3溶液,你认为可行的是___________。
|
|||||||||||||
| 22. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
(1)在这些元素中,⑩最高价氧化物的水化物为 。 (2)写出①的最高价氧化物和②的单质的电子式 , 。 (3)用电子式表示③与④形成化合物的过程 。 (4)①的单质和⑥的氧化物反应的化学方程式 。 (5)写出⑤的单质与氢氧化钠反应的化学方程式: 写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。 (6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
|
|||||||||||||||||||||||||||||||||||||
| 23. | 详细信息 |
|
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答 (1)写出元素符号A: ,B: ,C: 。 (2)D2A的电子式 , (3)D2A2的化学式 ,灼烧这化合物火焰呈 色。 (4)C在元素周期表中的位置是 ,其原子结构示意图为 。 (5)比较A、B气态氢化物的沸点 ;原因 。
|
|
| 24. | 详细信息 | |||||||||||||||||||||||||||||||
|
某课外兴趣小组对H2O2的分解速率做了如下实验探究。 ⑴下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据: 用10mL H2O2制取150mLO2所需的时间(秒)
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解速率的影响。 ②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响? 。 ⑵将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
①写出H2O2发生的化学反应方程式_______________ ____。 ②实验结果说明催化剂作用的大小与________ ________________有关。
|
||||||||||||||||||||||||||||||||
| 25. | 详细信息 |
|
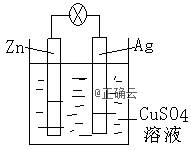
Ⅰ(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电 池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为 ,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将 (填“增大” “减小” 或“不变”)。 (2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。 回答下列问题:锌为 极,该电极上发生 反应(“氧化”或“还原”),电极反应式为 ,该原电池的总反应离子方程式为 。
Ⅱ.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反:3A(g)+B(g) (1)平衡时D的浓度= , (2)B的平均反应速率v(B)= , (3)x= , (4)开始时容器中的压强与平衡时的压强之比为 (化为最简整数比) (5)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应 ;每消耗3.4gNH3转移的电子数目为 。
|
|