2017高二下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列说法中正确的是( ) A. 处于最低能量的原子叫做基态原子 B. 3s2表示3s能级有两个轨道 C. 同一原子中,1s、2s、3s电子的能量逐渐减小 D. 同一原子中,3d、4d、5d能级的轨道数依次增多
|
|
| 2. | 详细信息 |
|
下列各微粒的基态电子排布式或电子排布图正确的是( ) A. C C. B
|
|
| 3. | 详细信息 |
|
周期表中有如图所示的元素,下列叙述正确的是( )
A. 钛元素原子的M层上共有10个电子 B. 钛元素是ds区的过渡元素 C. 钛元素原子最外层上有4个电子 D. 47.87是钛原子的平均相对原子质量
|
|
| 4. | 详细信息 |
|
“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是( ) A. 构造原理 B. 泡利原理 C. 洪特规则 D. 能量最低原理
|
|
| 5. | 详细信息 |
|
电子构型为3d54s2的元素属于下列哪一类元素( ) A. 稀有气体 B. 主族元素 C. 过渡元素 D. 卤族元素
|
|
| 6. | 详细信息 |
|
下列各组微粒中不属于等电子体的是( ) A. CH4、NH C. CO2、N2O D. H2O、HF
|
|
| 7. | 详细信息 |
|
根据相似相溶规则和实际经验,下列叙述不正确的是( ) A. 白磷(P4)易溶于CS2,但难溶于水 B. NaCl易溶于水,难溶于CCl4 C. 碘易溶于苯,微溶于水 D. 卤化氢易溶于水,也易溶于CCl4
|
|
| 8. | 详细信息 |
|
下列事实与氢键无关的是( ) A. 液态氟化氢中有三聚氟化氢(HF)3分子存在 B. 冰的密度比液态水的密度小 C. H2O的分解温度比H2S高 D. 乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水
|
|
| 9. | 详细信息 |
|
下列关于价层电子对互斥模型(VSEPR模型)的叙述中不正确的是( ) A. VSEPR模型可用来预测分子的立体结构 B. 分子中价电子对相互排斥决定了分子的空间结构 C. 中心原子上的孤电子对不参与互相排斥 D. 分子中键角越大,价电子对相互排斥力越小,分子越稳定
|
|
| 10. | 详细信息 |
|
下列说法正确的是( ) A. 1 mol 金刚石晶体中,平均含有1 mol C—C键 B. BCl3中B原子以sp2杂化,分子为平面三角形 C. 氢键具有方向性和饱和性,也属于一种化学键 D. (HO)2RO3的酸性比(HO)2RO2弱
|
|
| 11. | 详细信息 |
|
中国科学家在南海成功开采了一种新能源——“可燃冰”。它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)。其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是( ) A. 离子晶体 B. 分子晶体 C. 原子晶体 D. 金属晶体
|
|
| 12. | 详细信息 |
|
下列各组分子中,都属于含极性键的非极性分子的是 A. C2H4 CH4 B. CO2 H2S C. C60 C2H4 D. NH3 HCl
|
|
| 13. | 详细信息 |
|
已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( ) A. 原子半径:A>B>C>D B. 原子序数:d>c>b>a C. 离子半径:C3->D->B+>A2+ D. 元素的第一电离能:A>B>D>C
|
|
| 14. | 详细信息 |
|
有关乙炔分子中的化学键描述不正确的是 A. 两个碳原子采用sp杂化方式 B. 两个碳原子形成两个π键 C. 每个碳原子都有两个未杂化的2p轨道形成π键 D. 两个碳原子采用sp2杂化方式
|
|
| 15. | 详细信息 |
|
区别晶体与非晶体的最科学的方法是( ) A. 观察自范性 B. 观察各向异性 C. 测定固定熔点 D. 进行X-射线衍射实验
|
|
| 16. | 详细信息 |
|
下列分子中的中心原子杂化轨道的类型相同的是( ) A. CO2与SO2 B. BeCl2与BF3 C. CH4与NH3 D. C2H2与C2H4
|
|
| 17. | 详细信息 |
|
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因 A. 电子由激发态向基态跃迁时以光的形式释放能量 B. 电子由基态向激发态跃迁时吸收除红光以外的光线 C. 氖原子获得电子后转变成发出红光的物质 D. 在电流的作用下,氖原子与构成灯管的物质发生反应
|
|
| 18. | 详细信息 |
|
碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为 A. CCl4与I2分子量相差较小,而H2O与I2分子量相差较大 B. CCl4与I2都是直线型分子,而H2O不是直线型分子 C. CCl4和I2都不含氢元素,而H2O中含有氢元素 D. CCl4和I2都是非极性分子,而H2O是极性分子
|
|
| 19. | 详细信息 |
|
下列说法中正确的是 A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构 B. PH3和CH4都是正四面体形分子且键角都为109°28′ C. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 D. NH4+的电子式为
|
|
| 20. | 详细信息 |
|
下列现象与氢键有关的是: ①H2O的熔、沸点比VIA族其他元素氢化物的高 ②小分子的醇、羧酸可以和水以任意比互溶 ③冰的密度比液态水的密度小 ④尿素的熔、沸点比醋酸的高 ⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 ⑥水分子高温下也很稳定 A. ①②③④⑤⑥ B. ①②③④⑤ C. ①②③④ D. ①②③
|
|
| 21. | 详细信息 |
|
已知X、Y均为主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的( )
A. 元素X的常见化合价是+1价 B. 元素Y是ⅢA族的元素 C. 元素X与氯形成化合物时,化学式可能是XCl D. 若元素Y处于第3周期,它可与冷水剧烈反应
|
|
| 22. | 详细信息 |
|
关于Cl的说法正确的是( )
A. 中心原子的化合价为+2价 B. 配体为水分子,外界为Cl- C. 配位数是6 D. 在其水溶液中加入AgNO3溶液,不产生白色沉淀
|
|
| 23. | 详细信息 |
|
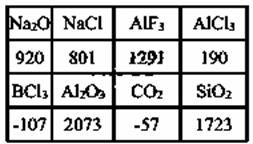
下图中数据是对应物质的熔点(℃),据此做出的下列判断中正确的是( )
A. 铝的化合物的晶体中有的是离子晶体 B. 表中只有 BCl3 和CO2是分子晶体 C. 同族元素的氧化物只能形成同类型的晶体 D. 不同族元素的氧化物不能形成相同类型晶体
|
|
| 24. | 详细信息 |
|
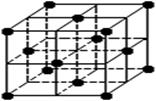
下列关于晶体的说法,一定正确的是( )
A. 分子晶体中都存在共价键 B. CaTiO3晶体(如图所示)中每个Ti4+与12个O2-紧邻 C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合 D. 金属晶体的熔点都比分子晶体的熔点高
|
|
| 25. | 详细信息 |
|
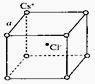
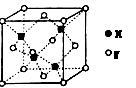
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
A.
|
|
| 26. | 详细信息 |
|
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。 回答下列问题: (1) 元素M的核外电子排布式________ ;元素L的电子排布图为________ ; (2)五种元素的原子半径从大到小的顺序是____________(用元素符号表示)。Y、Z、L的电离能由大到小的顺序是______________(用元素符号表示) (3)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的分子空间构型为__________,中心原子的杂化方式是________,A的电子式为____________,B的结构式为____________。 (4)NO3-的空间构型为__________;写出NO3-互为等电子体的一种分子的化学式_____________。 (5)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为____,每个Ba2+与__个O2-配位。
|
|
| 27. | 详细信息 | ||||||||||||||
|
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题: (1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________。 (2)e与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。 (3)请写出f的氰化物在水中所存在氢键的表达式: ____________(任写两种即可)。 (4)o、p两元素的部分电离能数据列于下表:
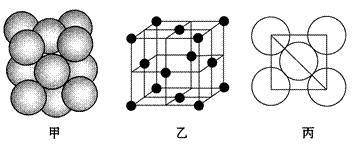
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是________________________________________________________________; (5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
请问晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。
|
|||||||||||||||
| 28. | 详细信息 |
|
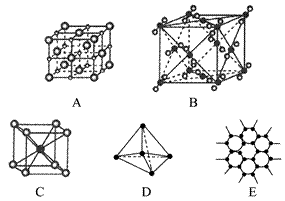
如下图所示表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨晶体结构中的某一种的某一部分。
(1)其中代表金刚石的是(填编号字母,下同)________,其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。 (2)其中代表石墨的是_______,其中每个正六边形占有碳原子数平均为________个。 (3)其中代表NaCl晶体的是________,每个Na+周围与它最接近且距离相等的Na+有________个。 (4)代表CsCl晶体的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。 (5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。 (6)上述五种物质熔点由高到低的排列顺序为________。
|
|
| 29. | 详细信息 |
|
X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题: (1)元素X在元素周期表中位于_______区,单质X的晶体类型为____________,其中X原子的配位数为______________。 (2)已知元素Y可与元素Z的相对原子质量只差为16,则元素Y基态原子的外围电子排布图为______________________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。 (3)X的氯化物与氨水反应可形成配合物Cl2,1mol该配合物中含有σ键的数目为______________________。 (4)X与Y形成的一种化合物的立方晶胞如图所示。
该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
|
|

 ,离子呈平面正方形结构
,离子呈平面正方形结构