2020иҘҝи—Ҹй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯдёҚеұһдәҺй“ҒеҗҲйҮ‘зҡ„жҳҜ A. дёҚй”Ҳй’ўВ В В В В B. з”ҹй“Ғ В В В В В В C. зўізҙ й’ўВ В В В В В D. ж°§еҢ–й“Ғ
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
еҲҶзұ»жҳҜеӯҰд№ е’Ңз ”з©¶еҢ–еӯҰзҡ„дёҖз§ҚйҮҚиҰҒж–№жі•пјҢдёӢеҲ—еҲҶзұ»еҗҲзҗҶзҡ„жҳҜ AпјҺзғ§зўұе’ҢзәҜзўұйғҪеұһдәҺзўұВ В В В В В В В В В В BпјҺзЎ«й…ёе’Ңзӣҗй…ёйғҪеұһдәҺеҗ«ж°§й…ё CпјҺNa2SiO3е’ҢNa2SO4йғҪеұһдәҺй’ зӣҗ В В В В В В DпјҺFe2O3е’ҢAl2O3йғҪеұһдәҺзўұжҖ§ж°§еҢ–зү©
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…ізү©иҙЁжҖ§иҙЁдёҺз”ЁйҖ”дёҚе…·жңүеҜ№еә”е…ізі»зҡ„жҳҜ AпјҺFeCl3жә¶ж¶Іе‘Ҳй…ёжҖ§пјҢеҸҜз”ЁдәҺи…җиҡҖCu BпјҺе°ҸиӢҸжү“еҸ—зғӯеҲҶи§Јз”ҹжҲҗж°”дҪ“пјҢеҸҜз”ЁдҪңеҸ‘й…өзІү CпјҺж°ўж°§еҢ–й“қе…·жңүдёӨжҖ§пјҢеҸҜз”ЁдәҺдёӯе’ҢиҝҮеӨҡиғғй…ё DпјҺAl2O3зҶ”зӮ№й«ҳпјҢеҸҜз”ЁдҪңиҖҗй«ҳжё©жқҗж–ҷ
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢж“ҚдҪңдёӯдёҚжӯЈзЎ®зҡ„жҳҜ AпјҺеҲҶж¶Іж—¶пјҢеҲҶж¶ІжјҸж–—дёӢеұӮж¶ІдҪ“д»ҺдёӢеҸЈж”ҫеҮәпјҢдёҠеұӮж¶ІдҪ“д»ҺдёҠеҸЈеҖ’еҮә BпјҺи’ёйҰҸж—¶пјҢеә”е°Ҷжё©еәҰи®Ўж°ҙ银зҗғж”ҫеңЁиў«еҠ зғӯзҡ„ж··еҗҲж¶Ідёӯ CпјҺиҝҮж»Өж—¶пјҢйңҖиҰҒз”ЁзҺ»з’ғжЈ’еј•жөҒ DпјҺдҪҝз”ЁеҲҶж¶ІжјҸж–—еҲҶж¶ІеүҚиҰҒе…ҲжЈҖжјҸ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ AпјҺйҮ‘еұһй’ е’Ңж°ҙеҸҚеә”пјҡNa+2H2O = Na++2OHвҖ”+H2вҶ‘ BпјҺNa2CO3жә¶ж¶ІдёӯеҠ е…ҘзЁҖзӣҗй…ёпјҡCO32- + 2H+ = CO2вҶ‘+ H2O CпјҺй“ҒзүҮж”ҫе…ҘзЁҖзЎ«й…ёдёӯпјҡ2Fe + 6H+ = 2Fe3+ + 3H2вҶ‘ DпјҺе°Ҷжү“зЈЁеҗҺзҡ„й“қдёқжҸ’е…ҘNaOHжә¶ж¶ІдёӯпјҡAl+2OHп№ЈпјқAlO2п№Ј+H2вҶ‘
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺ23g NaдёҺи¶ійҮҸH2OеҸҚеә”е®Ңе…ЁеҗҺеҸҜз”ҹжҲҗNAдёӘH2еҲҶеӯҗ BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2L H2Oдёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә0.5NA CпјҺ5.6gй“ҒдёҺи¶ійҮҸзӣҗй…ёеҸҚеә”иҪ¬з§»зҡ„з”өеӯҗж•°дёә0.3NA DпјҺ16g O2еҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣ®дёәNA
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
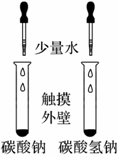
е…ідәҺNaHCO3е’ҢNa2CO3зҡ„жҖ§иҙЁеҲӨж–ӯжӯЈзЎ®зҡ„жҳҜ AпјҺзғӯзЁіе®ҡжҖ§пјҡNaHCO3пјңNa2CO3 BпјҺеёёжё©дёӢзӣёеҗҢзү©иҙЁзҡ„йҮҸжө“еәҰжә¶ж¶Ізҡ„зўұжҖ§пјҡNaHCO3пјһNa2CO3 CпјҺеёёжё©дёӢжә¶и§ЈеәҰпјҡNaHCO3пјһNa2CO3 DпјҺдёҺеҗҢжө“еәҰгҖҒеҗҢдҪ“з§Ҝзҡ„зӣҗй…ёеҸҚеә”з”ҹжҲҗж°”дҪ“зҡ„еҝ«ж…ўпјҡNaHCO3пјңNa2CO3
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйҮ‘еұһзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ AпјҺй’ дёҺж°§ж°”еҸҚеә”ж—¶пјҢдә§зү©жҳҜз”ұж°§ж°”зҡ„з”ЁйҮҸеҶіе®ҡзҡ„ BпјҺй“қз®”еңЁз©әж°”дёӯеҸ—зғӯеҸҜд»ҘзҶ”еҢ–ж»ҙиҗҪ CпјҺй“ңеҸҜд»ҘеңЁеҠ зғӯзҡ„жқЎд»¶дёӢе’Ңж°§ж°”еҸҚеә”пјҢз”ҹжҲҗж°§еҢ–й“ң DпјҺй“ҒдёҺж°ҙи’ёж°”еҸҚеә”зҡ„дә§зү©жҳҜй»‘иүІзҡ„Fe2O3
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢеҲ—е®һйӘҢж–№жЎҲдёӯпјҢдёҚиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜ
|
||||||||||||||||
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
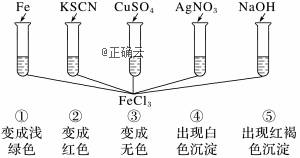
дёәдәҶйӘҢиҜҒFe3пјӢзҡ„жҖ§иҙЁпјҢи®ҫи®ЎдәҶдёӢеӣҫжүҖзӨәзҡ„дёҖз»„е®һйӘҢпјҢе…¶дёӯе®һйӘҢж–№жЎҲи®ҫи®Ўй”ҷиҜҜзҡ„жҳҜ
AпјҺв‘ЎВ В В В В В В В BпјҺв‘ўв‘ЈВ В В В В В В В CпјҺв‘ўв‘ӨВ В В В В В В DпјҺв‘ в‘Ўв‘ўв‘Јв‘Ө
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯж—ўиғҪдёҺзЁҖH2SO4еҸҚеә”пјҢеҸҲиғҪдёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„жҳҜ в‘ NaHCO3гҖҖв‘ЎAl2O3гҖҖв‘ўAlгҖҖв‘ЈNa2CO3гҖҖв‘ӨNaHSO4 AпјҺв‘Ўв‘ўв‘ЈВ В В В В В В BпјҺв‘ в‘Ўв‘ўВ В В В В В В CпјҺв‘ в‘ўв‘ЈВ В В В В В В DпјҺе…ЁйғЁ
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||
|
ж¬ІиҝӣиЎҢдёӢеҲ—е®һйӘҢпјҢе…¶ж–№жЎҲи®ҫи®ЎеҗҲзҗҶзҡ„жҳҜ
|
|||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
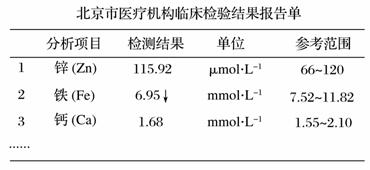
дёӢеӣҫжҳҜжҹҗе„ҝз«Ҙеҫ®йҮҸе…ғзҙ дҪ“жЈҖжҠҘе‘ҠеҚ•зҡ„йғЁеҲҶж•°жҚ®пјҢж №жҚ®ж•°жҚ®пјҢеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
(1)иҜҘе„ҝз«ҘдҪ“еҶ…В В В В В В В В е…ғзҙ еҗ«йҮҸеҒҸдҪҺгҖӮ (2)жҠҘе‘ҠеҚ•дёӯвҖңОјmolВ·LпјҚ1вҖқжҳҜВ В В В В В В В В (еЎ«вҖңиҙЁйҮҸвҖқвҖңдҪ“з§ҜвҖқжҲ–вҖңжө“еәҰвҖқ)зҡ„еҚ•дҪҚгҖӮ (3)жңҚз”Ёз»ҙз”ҹзҙ CеҸҜдҪҝйЈҹзү©дёӯзҡ„Fe3пјӢиҪ¬еҢ–дёәFe2пјӢгҖӮеңЁиҝҷдёӘиҝҮзЁӢдёӯдҪ“зҺ°з»ҙз”ҹзҙ Cзҡ„В В В В В В В жҖ§гҖӮ (4)зјәй“ҒжҖ§иҙ«иЎҖжӮЈиҖ…еә”иЎҘе……Fe2пјӢгҖӮдёҖдәӣиЎҘй“ҒеүӮд»ҘзЎ«й…ёдәҡй“Ғдёәдё»иҰҒжҲҗеҲҶпјҢе°ҶзЎ«й…ёдәҡй“ҒеҲ¶жҲҗиҚҜзүҮж—¶еӨ–иЎЁеҢ…жңүдёҖеұӮзү№ж®Ҡзҡ„зі–иЎЈпјҢжҺЁжөӢзі–иЎЈзҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В гҖӮ (5)еҸ–иЎҘиЎҖеүӮзүҮз”Ёз ”й’өз ”з»ҶпјҢеҠ е…ҘиҝҮйҮҸзЁҖзЎ«й…ёпјҢеҸ–жҫ„жё…ж¶ІпјҢ然еҗҺж»ҙеҠ KSCNжә¶ж¶ІпјҢиӢҘжә¶ж¶ІеҸҳдёәзәўиүІпјҢеҲҷжә¶ж¶Ідёӯеҗ«жңүВ В В В В В В (еЎ«зҰ»еӯҗз¬ҰеҸ·)пјҢиҜҙжҳҺиЎҘиЎҖеүӮжҳҜеҗҰеҸҳиҙЁВ В В В В В В В В В В гҖӮ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
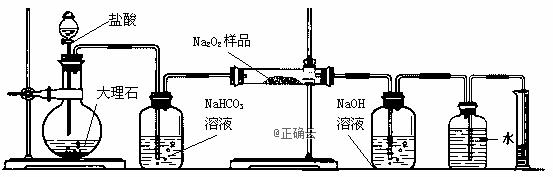
иҝҮж°§еҢ–й’ дҝқеӯҳдёҚеҪ“е®№жҳ“еҸҳиҙЁгҖӮжҹҗиҜҫеӨ–жҙ»еҠЁе°Ҹз»„дёәдәҶзІ—з•ҘжөӢе®ҡиҝҮж°§еҢ–й’ зҡ„иҙЁйҮҸеҲҶж•°пјҢ他们称еҸ–2.0gж ·е“ҒпјҢ并и®ҫи®Ўз”ЁдёӢеӣҫиЈ…зҪ®жқҘжөӢе®ҡиҝҮж°§еҢ–й’ зҡ„иҙЁйҮҸеҲҶж•°гҖӮеӣҫдёӯзҡ„Eе’ҢFжһ„жҲҗйҮҸж°”иЈ…зҪ®пјҢз”ЁжқҘжөӢе®ҡO2зҡ„дҪ“з§ҜгҖӮ
AВ В В В В BВ В В В В В В В В В В CВ В В В В В В DВ В В В EВ В В В F пјҲ1пјүеҶҷеҮәиЈ…зҪ®AдёӯдёӨз§Қдё»иҰҒзҺ»з’ғд»ӘеҷЁзҡ„еҗҚз§°В В В В В В В В В гҖҒВ В В В В В В гҖӮ пјҲ2пјүеҶҷеҮәиЈ…зҪ®AдёӯеҸ‘з”ҹзҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В гҖҖгҖҖВ В В В В В В В В В В В В гҖӮ пјҲ3пјүиЈ…зҪ®Bзҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүеҶҷеҮәиЈ…зҪ®CдёӯеҸ‘з”ҹеҸҚеә”зҡ„дё»иҰҒеҢ–еӯҰж–№зЁӢејҸпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ5пјүиЈ…зҪ®Dдёӯ NaOHзҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖҖгҖҖгҖҖВ В В В В В гҖӮ пјҲ6пјү他们еңЁиҜ»еҮәйҮҸзӯ’еҶ…ж°ҙзҡ„дҪ“з§Ҝж•°еҗҺпјҢжҠҳз®—жҲҗж ҮеҮҶзҠ¶еҶөдёӢж°§ж°”зҡ„дҪ“з§Ҝдёә224mLпјҢеҲҷж ·е“ҒдёӯиҝҮж°§еҢ–й’ зҡ„иҙЁйҮҸеҲҶж•°дёәВ В В В В В В В В
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
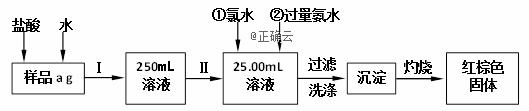
жҹҗж°ҜеҢ–й“ҒпјҲFeCl3пјүж ·е“Ғеҗ«жңүе°‘йҮҸFeCl2жқӮиҙЁгҖӮзҺ°иҰҒжөӢе®ҡе…¶дёӯй“Ғе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°пјҢе®һйӘҢжҢүд»ҘдёӢжӯҘйӘӨиҝӣиЎҢпјҢж №жҚ®жөҒзЁӢеӣһзӯ”д»ҘдёӢй—®йўҳпјҡ
пјҲ1пјүж“ҚдҪңIжҳҜй…ҚеҲ¶жә¶ж¶ІпјҢжүҖз”ЁеҲ°зҡ„зҺ»з’ғд»ӘеҷЁйҷӨзғ§жқҜгҖҒзҺ»з’ғжЈ’еӨ–пјҢиҝҳеҝ…йЎ»жңү В В В В В В гҖҒВ В В В В В гҖӮ пјҲ2пјүеҶҷеҮәеҠ е…Ҙж°Ҝж°ҙеҸ‘з”ҹзҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүеҶҷеҮәеҠ е…ҘиҝҮйҮҸж°Ёж°ҙеҸ‘з”ҹзҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ4пјүеҶҷеҮәзҒјзғ§еҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ5пјүжЈҖйӘҢжІүж·ҖжҳҜеҗҰе·Із»Ҹжҙ—ж¶Өе№ІеҮҖзҡ„ж“ҚдҪңжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ6пјүдёӢеҲ—ж“ҚдҪңеҸҜиғҪдҪҝжүҖй…Қжә¶ж¶Іжө“еәҰеҒҸе°Ҹзҡ„жҳҜВ В В В В В В В В пјҲеЎ«еҶҷеәҸеҸ·пјүгҖӮ в‘ жңӘжҙ—ж¶Өзғ§жқҜе’ҢзҺ»з’ғжЈ’В В В В В В В В В В В В В В в‘Ўе®ҡе®№ж—¶дҝҜи§Ҷе®№йҮҸ瓶зҡ„еҲ»еәҰзәҝ в‘ўй…Қжә¶ж¶ІеүҚе®№йҮҸ瓶дёӯжңүе°‘йҮҸи’ёйҰҸж°ҙВ В В В в‘Јж‘ҮеҢҖеҗҺпјҢеҸ‘зҺ°ж¶ІйқўдҪҺдәҺеҲ»еәҰзәҝеҗҺ继з»ӯеҠ ж°ҙиҮіеҮ№ж¶ІйқўдёҺеҲ»еәҰзәҝзӣёеҲҮ пјҲ7пјүиӢҘеҺҹж ·е“ҒиҙЁйҮҸaдёә10gпјҢеҠ зғӯеҗҺзәўжЈ•иүІеӣәдҪ“иҙЁйҮҸжҳҜ0.6gпјҢеҲҷж ·е“Ғдёӯй“Ғе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°жҳҜВ В В В В В В В В В В В гҖӮ
|
|
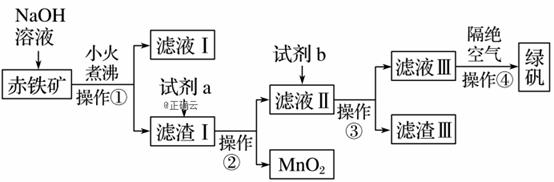
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ҘдёҡдёҠз”ЁиөӨй“Ғзҹҝ(еҗ«Fe2O3гҖҒFeOпјҢд№ҹеҗ«жңүAl2O3гҖҒMnO2гҖҒCuOзӯү)еҲ¶еӨҮFeSO4В·7H2O(з»ҝзҹҫ)зҡ„жөҒзЁӢеҰӮдёӢпјҡ
(1)е®һйӘҢе®Өдёӯж“ҚдҪңв‘ зҡ„еҗҚз§°дёәВ В В В В В В гҖӮжүҖйңҖзҡ„зҺ»з’ғд»ӘеҷЁжңүзғ§жқҜгҖҒВ В В В В В В гҖҒВ В В В В В В гҖӮ (2)ж°ўж°§еҢ–й’ жә¶ж¶ІеҠ е…ҘиөӨй“ҒзҹҝдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ (3)еҠ е…Ҙж»ӨжёЈв… дёӯзҡ„иҜ•еүӮaжҳҜВ В В В В В В В В В пјҢж»Өж¶Ів…Ўдёӯзҡ„дё»иҰҒйҮ‘еұһйҳізҰ»еӯҗжңүВ В В В В В В В В В В В гҖӮ (4)иҜ•еүӮbдёәВ В В В В В В В В В В В В В В В В гҖӮ (5)ж»ӨжёЈв…ўдёӯзҡ„дё»иҰҒжҲҗеҲҶжҳҜВ В В В В В В В В В В гҖӮж“ҚдҪңв‘Јйҡ”з»қз©әж°”зҡ„зӣ®зҡ„жҳҜВ В В В В В В В В В В В В В В В гҖӮ
|
|
- 2019-2020е№ҙй«ҳдёү12жңҲжңҲиҖғеҢ–еӯҰиҖғиҜ•е®Ңж•ҙзүҲпјҲжІіеҢ—зңҒе®ЈеҢ–еёӮ第дёҖдёӯеӯҰпјү
- дё№дёңеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•ж‘ёеә•иҖғиҜ•йўҳ
- йІҒ科зүҲйҖүжӢ©жҖ§еҝ…дҝ®1第1з« еҢ–еӯҰеҸҚеә”дёҺиғҪйҮҸиҪ¬еҢ–еҫ®йЎ№зӣ®и®ҫи®ЎиҪҪдәәиҲӘеӨ©еҷЁз”ЁеҢ–еӯҰз”өжұ дёҺж°§ж°”еҶҚз”ҹж–№дәІ--еҢ–еӯҰеҸҚеә”дёӯиғҪйҮҸеҸҠзү©иҙЁзҡ„иҪ¬еҢ–еҲ©з”Ё
- жҺЁиҚҗй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2018е№ҙиҮі2019е№ҙй«ҳдёҖдёӢеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲпјҲеҗүжһ—зңҒеҗүжһ—еёӮдёүж Ўпјү
- 2019еұҠй«ҳдёүдёҠеҶҢ第дёүж¬ЎжңҲиҖғеҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·пјҲжІіеҚ—зңҒе‘ЁеҸЈдёӯиӢұж–ҮеӯҰж Ўпјү
- ж·®еҚ—еӣӣдёӯй«ҳдёүеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·жЁЎжӢҹиҖғиҜ•и®ӯз»ғ
- ж–°з–ҶжҳҢеҗү第д№қдёӯеӯҰ2021еұҠй«ҳдёүдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ