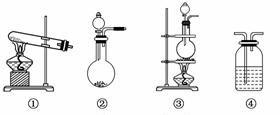
实验2-3 从海带中提取碘 知识点题库
①通入足量Cl2 ②将海带焙烧成灰后加水搅拌 ③加CCl4振荡 ④用分液漏斗分液 ⑤过滤 合理的操作顺序是.
①将海带烧成灰,在海带灰中加水搅拌②加四氯化碳搅拌③通入氯气④过滤⑤用分液法分离液体混合物
以上操作的先后顺序为( )
-
(1) 碘与氯是同族元素,它们位于元素周期表的第 族;HI的稳定性比HCl (填“强”或“弱”,下同),HI的还原性比HCl
-
(2) 自然界中的碘有的以NaIO3形态存在于硝石(NaNO3)中,向硝石母液中加入NaHSO3可以制得I2 , 请写出NaIO3溶液和NaHSO3溶液反应的离子方程式
-
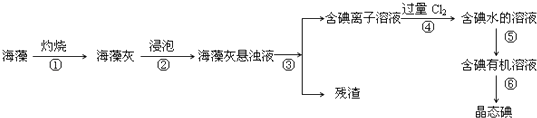
(3) 碘还以碘化物的形态存在于海水中,被海藻类植物吸收而富集,从海带中提取碘的过程如图:
步骤③的操作名称为 ;
步骤④发生反应的离子方程式为 ;
步骤③得到的滤液中c(I﹣)=0.004mol/L,取10mL滤液加入10mL Pb(NO3)2溶液,若要生成PbI2沉淀,则所加Pb(NO3)2溶液的浓度应大于 mol/L[已知Ksp(PbI2)=9.8×10﹣9]
-
(4)
为了预防地方性甲状腺肿和地方性克汀病等碘缺乏病,可在食盐中加入KIO3 . KIO3在工业上可用电解法制取.以铂为阳极、不锈钢为阴极,以KI和 KOH混合溶液为电解液,请写出阳极的电极反应式 ;电解池总反应的化学方程式为

海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如图所示实验:

请填写下列问题:
-
(1) 实验室灼烧海带应在 (填仪器名称)内进行
-
(2) 步骤④反应的离子方程式是
-
(3) 步骤⑤中,应选用的一种溶剂X可以是 (填试剂名称).
-
(4)
上述流程中的实验操作包括图中的 (按操作顺序选填代号).

-
(5) 设计一个简单的实验,检验提取碘后的溶液中是否还含有单质碘
-
(1) 写出步骤④对应反应的离子方程式:.
-
(2) 步骤④除了加入过量Cl2 , 下列氧化剂最好选用(填代号).
A.浓硫酸 B.H2O2溶液 C.KMnO4溶液
理由是.
-
(3) 步骤⑤中,某学生选择用苯提取碘的理由是.
-
(4) 设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法.

-
(1) 指出过程中有关的实验操作①和②名称:①,②.
-
(2) 选择试剂①时,若要考虑实验尽量不放出有害气体,可选择
A.氯气 B.氟化钠 C.稀硫酸 D.次氯酸钠
实验指导教师则给出了10%H2O2和2mol/L稀硫酸,请写出碘离子与这些物质发生反应的离子方程式:
-
(3) 选择试剂②,可供选择的试剂是 .A . 酒精 B . CCl4 C . 苯 D . 氢氧化钠
-
(4) 在操作②过程中:①分液漏斗中上层液体从.
②要检验在操作②后水溶液中是否含碘单质的方法:.
-
(5) 有色液体呈色.从此液体中提取碘和回收有机溶剂,还需要经过蒸馏过程.指出下图蒸馏实验装置中的错误是
①温度计水银球位置错误 ②冷却水的方向错 ③酒精灯加热错 ④烧杯直接加热错.


| 编号 | 实验目的 | 实验设计 |
| A | 除去Cl2中少量的HCl | 将混合气体通过饱和NaHCO3溶液 |
| B | 除去FeCl2溶液中混有的FeCl3 | 向混合物中滴加适量铜粉,再过滤 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再加KSCN溶液 |
| D | 证明Cl2的氧化性比I2强 | 将Cl2通入淀粉碘化钾溶液中 |
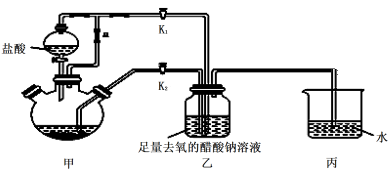
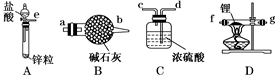
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2 , 打开K1 , 旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
-
(1) 三颈烧瓶中的Zn与盐酸生成H2的作用,还发生的另一个反应的离子方程式为。
-
(2) 实现步骤③中溶液自动转移至装置乙中的实验操作为,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,需采用的操作是 、、洗涤、干燥。
-
(3) 装置丙中导管口水封的目的是。
-
(4) 铬的离子会污染水,常温下要除去上述实验中多余的Cr2+ , 最好往废液中通入足量的空气,再加入碱液,调节pH至少为才能使铬的离子沉淀完全。[已知Cr(OH)3的溶度积为1×10−32]
-
(5) 若实验所取用的CrCl3溶液中含溶质6.34 g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是。
 B . 过滤含碘离子溶液
B . 过滤含碘离子溶液 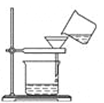 C . 放出碘的苯溶液
C . 放出碘的苯溶液 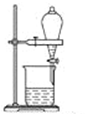 D . 分离碘并回收苯
D . 分离碘并回收苯 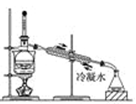
| 编号 | 实验过程 | 实验目的 |
| A | 称取2gCuSO4•5H2O溶于98g水中,充分搅拌溶解,然后装入试剂瓶中 | 配制2%的CuSO4溶液 |
| B | 将活性炭放入盛有NO2的锥形瓶中,观察气体颜色 | 探究碳的还原性 |
| C | 将ZnSO4溶液滴入盛有2mLNa2S溶液的试管中至不再产生沉淀,然后滴入相同浓度的CuSO4溶液,观察现象 | 比较ZnS(白色)和CuS(黑色)的溶度积 |
| D | 向两支试管中分别加入2mL5%H2O2溶液然后只向其中一支试管中加入绿豆大小的FeI2固体,观察比较现象 | 探究I-对H2O2分解是否具有催化作用 |
甲同学的实验方案如下:
-
(1) 仪器的组装连接:上述仪器装置接口的连接顺序为,加入药品前首先要进行的实验操作是(不必写出具体的操作方法);其中装置B的作用是。
-
(2) 添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯(一种有机化合物)中浸洗数次,该操作的目的是除去锂表面的石蜡,然后快速把锂放入到石英管中。通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是。
-
(3) 加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。分析该反应原理,完成LiH与水反应的化学方程式。
-
(4) 准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为。
 合成
合成  的反应类型有:
的反应类型有: 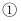 取代
取代  水解
水解  反应
反应  加成反应
加成反应 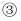 消去反应
消去反应 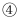 氧化反应按反应的先后顺序最合理的反应组合是( )
氧化反应按反应的先后顺序最合理的反应组合是( )
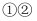 B .
B . 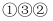 C .
C . 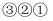 D .
D . 
-
(1) Ⅰ.海带中碘元素的确定
海带
 海带灰
海带灰 
 海带灰浸取液
海带灰浸取液取海带灰浸取液
 ,加入稀硫酸约
,加入稀硫酸约  、5%的
、5%的  溶液约
溶液约  ,然后加入
,然后加入  约
约  ,振荡后静置,可以观察到,证明海带中含有碘元素,该反应的离子方程式为。
,振荡后静置,可以观察到,证明海带中含有碘元素,该反应的离子方程式为。 -
(2) Ⅱ.海带提碘
海带灰浸取液
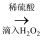 含I2的水溶液
含I2的水溶液  碘的有机溶液→晶体碘
碘的有机溶液→晶体碘若向
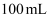 碘水L中加入
碘水L中加入  ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在  中的物质的量浓度是水中的86倍,则萃取效率为%(结果保留小数点后两位)(萃取效率
中的物质的量浓度是水中的86倍,则萃取效率为%(结果保留小数点后两位)(萃取效率  )。
)。 -
(3) 萃取实验中,若要使碘尽可能地完全转移到
 中,可以采取的操作是。
中,可以采取的操作是。
-
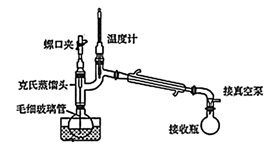
(4) 某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是。
-
(5) Ⅲ.海带中碘含量的测定
若称取干海带
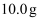 ,经灼烧、浸取、
,经灼烧、浸取、  氧化等过程后配制成
氧化等过程后配制成 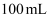 溶液,移取
溶液,移取 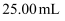 于锥形瓶中,用
于锥形瓶中,用  标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的  溶液的平均体积为
溶液的平均体积为  ,计算海带中含碘的质量分数为%(结果保留小数点后两位)(已知
,计算海带中含碘的质量分数为%(结果保留小数点后两位)(已知  )。若滴定结束读数时俯视刻度线,会导致测定结果(填“偏高”“偏低”或“不影响”)。
)。若滴定结束读数时俯视刻度线,会导致测定结果(填“偏高”“偏低”或“不影响”)。