食品干燥剂、保鲜剂和真空包装的成分探究 知识点题库
据报道,全球每年浪费的粮食约有1000亿吨,其中,约300亿吨是加工过的食品.如图是一包烤花生的图片,图中的脱氧剂在食品防腐保鲜,特别是对延长含高油脂食品的保质期有着重要作用.请回答下列问题:
(1)花生中富含的营养素是(答出一种即可),检验这包脱氧剂中含铁粉的方法是 .
(2)脱氧剂的作用原理是脱氧剂中的铁粉与氧气、水发生反应生成氢氧化铁,写出该反应的化学方程式 .据此判断脱氧剂对食品具有防腐保鲜作用的原因是 (填序号).
a.脱氧剂具有杀菌、消毒作用
b.脱氧剂吸收水分,使食品保持干燥
c.脱氧剂吸收氧气,防止食品发生缓慢氧化
(3)钢铁是应用最广泛的金属材料,写出工业上炼铁原理的化学方程式 ;我们日常生活中使用的清洁球,就是用不锈钢丝制作的,这是利用了金属铁具有的;铝、铁、铜三种金属在历史上被人类使用的时间先后顺序是 , 你认为其原因可能是 .
(4)据统计,我国每年因金属腐蚀造成的经济损失约占国民生产总值的2%~4%,防止金属腐蚀具有重要意义.答出一种防止金属腐蚀的措施 .


-
(1) 钢铁是我们日常生活中使用最广泛的金属材料之一.生活中的铁制品却容易生锈,铁锈蚀的主要原因是;提出下列保护资源的建议,其中正确的是 (填字毋)
A.防止铁制品腐蚀
B.回收利用废旧铁制品
C.任意开采铁矿石
-
(2) 日常生活中,人们常把煤做成蜂窝状(如图),这样做的目的是 , 燃煤取暖若通风不畅,常引发煤气中毒事故,煤产生“煤气”的过程用化学方程式表示为 .除排放煤气外,燃煤与多种环境污染问题有关,下列环境污染与燃煤没有直接关系的是 .
A.酸雨 B.温室效应 C.臭氧层破坏 D.可吸入颗粒增加
-
(3) 干果类食品常采用真空包装,目的是将食品与隔绝.氮气常用作糕点包装袋内的填充气,氮气的下列性质,与该用途有关的是 (填字母).
A.无毒 B.难溶于水 C.化学性质稳定 D.密度与空气相近.
-
(1) 上网查阅包装袋内是纯度较高的铁粉,可以做“干燥剂”使食物保存较长的时间,主要吸收空气中的两种物质是食物保鲜所以也称“双吸剂”,吸收的物质指的是和(写化学式)
-
(2) 用铁粉而不用铁块作“双吸剂”的理由是.
-
(3) 小组设计了以下实验探究“双吸剂”是否失效,请你帮他们完成下列实验报告:
问题与猜想
实验步骤
实验现象
结论、化学方程式
双吸剂是否失效
取样品少量于试管中加入适量的
结论:双吸剂没有失效,有关反应的化学方程式:
-
(1) 包装熟食制品常加入防腐剂.丙酸钠是一种食品防腐剂,化学式为C3H5O2Na,丙酸钠是由种元素组成,它属于;(填“纯净物”或“混合物”)
-
(2) 小包装糕点类食品常采用充气包装,氮气是常用的填充气体,可以延长食品的保质期.请你根据氮气的性质写出选用氮气的主要原因是;
-
(3) “双吸剂”(主要成分是铁粉)是常用的干燥剂,既能吸收水,还能吸收氧气.铁粉的化学式为.所以说铁在潮湿的空气中容易.
唐代中药学家陈藏器在其《本草拾遗》中记载:“头疼欲死,鼻内吹硝石(主要成分KNO3)末,愈”。用药简单,功效显著。
东晋著名炼丹家、医药学家葛洪在炼丹过程中积累了大量的化学知识,善用化学反应,为病患解除病痛。在葛洪所著的《肘后备急方》中有“食肉方”,原文内容为:“取白炭灰,荻灰,等分,煎令如膏。此不宜预作,十日则歇。并可与去黑子,此大毒。”结合现代化学知识,翻译文中含义大致为:取等量的生石灰、草木灰(含K2CO3),用水煎煮、去渣浓缩。这药不适宜提前制出来,放置十天,就失效了。可用于去除痦子等黑点。有剧毒。“食肉方”原料易得,所用“荻灰”是各种柴草燃烧后的灰烬,现称草木灰,是常用的农家肥,其有效成分K2CO3的性质与Na2CO 3相似。“食肉方”巧妙地利用了反应产物的腐蚀性。
2015年诺贝尔生理学或医学奖获奖者屠呦呦,也正是看到《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”才得到灵感,开始研究从青蒿中提取抗疟疾药物。
1964年,越南战争爆发,山间丛林地区恶性疟疾猖獗,且对原有抗疟疾药物产生了耐药性,疟疾患者猛增。越南政府请求支援。1967年中国成立疟疾防治领导小组,1969年,以屠呦呦为组长中医中药专业组介入。他们整理了800多种可能的中药,但并未考虑使用青蒿,因为它的抑制率极不稳定,为12-80%,直至看到《肘后备急方》中将青蒿“绞汁”用药,才得到启发,改用乙醚(C2H5OC2H5)提取。1971年10月,青蒿的动物效价由30%~40%提高到95%。1971年12月下旬,用乙醚提取物与中性部分分别对小鼠、猴进行试验,显示100%的疗效。1972年5月,进行人体试验,试验相关数据如下表所示:

青蒿素,无色针状晶体,分子式为C15H22O5 , 制备熔点为156-157℃,易溶于氯仿、丙酮,可溶于乙醇、乙醚,几乎不溶于水。因其具有特殊的过氧基,对热不稳定,易受湿、热和还原性物质的影响而分解。
根据世卫组织的统计数据,自2000年起,撒哈拉以南非洲地区约2.4亿人受益于青蒿素联合疗法,约150万人因该疗法避免了疟疾导致的死亡。
回答下列问题:
-
(1) 草木灰属于(填“氮肥”、“磷肥”、“钾肥”)。
-
(2) 食肉方中发生的化合反应的化学方程式为。
-
(3) 对于间日性疟疾病人你给出的服药建议是,理由是。
-
(4) 下列说法,正确的是 (填字母序号)。A . 硝石中氮元素的化合价为+3 B . 青蒿素属于有机物 C . “食肉方”不能预作的原因是氢氧化钾能与二氧化碳反应变质 D . 从青蒿素的乙醚溶液中分离青蒿素,可采取加热蒸发的方法
-
(1) 密度最小的气体是。
-
(2) 胃液的主要成分是。
-
(3) 可做食品干燥剂的固体是。
-
(4) 属于大气污染物,且能形成酸雨的主要气体是,吸收该气体可选溶液,该反应的化学方程式。
(提出猜想)保鲜剂可能的组成:①只有Fe2O3;②Fe 和Fe2O3的混合物。
(实验探究1)保鲜剂的成分探究
-
(1) 取保鲜剂样品少量于试管中,加入过量稀盐酸,小组同学根据观察到的现象一致认为猜想②成立,他们观察到的现象是。
-
(2) (实验探究2)保鲜剂中Fe2O3含量的探究
称取保鲜剂样品1.0g装入硬质玻璃管中,按图1所示的装置进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应,待反应完全后,继续通CO气体直至玻璃管冷却。

先通入CO气体一段时间后再加热的目的是。
-
(3) 反应前后称量相关装置和物质的总质量,其数据如下表:
反应前
反应后
玻璃管和保鲜剂的总质量为128.0g
玻璃管和固体物质的总质量127.79g
①A装置中发生反应的化学方程式为。
②分析装中的数据,可计算得出保鲜剂中Fe2O3的质量分数为。
-
(4) 实验结束后,是否要先断开A与B的连接以防止B中的石灰水倒吸?为什么?。
-
(5) (反思评价)上述装置未进行尾气处理。于是对上地装量进行如图2改进。
装置B的作用是和。
-
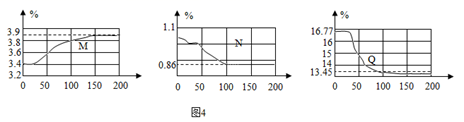
(6) (实验探究3)在如图3所示,保鲜袋中装有保鲜剂,将O2、CO2、湿度(测水蒸气)传感器探头放入保鲜袋中(有少量空气),然后快速向袋内呼出气体直到吹满,再打开仪器开始采集数据。采集的数据如图4所示,纵坐标均为某气体体积分数(%),横坐标均为时间(s)据图回答下列问题:

表示O2体积分数变化的曲线是(选填“M”或“N”或“Q”),指出曲线N在0~50s内下降的原因。
-
(7) 查阅文献得知其他人员使用铁的缓慢氧化原理来测量封闭容器内的氧气含量时;可以将氧气消耗至大约1%,但此处氧气剩余含量明显偏高,试解释原因(写出一条即可).
-
(8) 实验中,没有生成二氧化碳,但它的含量仍然发生了变化,请根据图象作出解释。
-
(1) 探究问题一:铁为什么能作双吸剂?
因为铁能与空气中的(填名称,下一空同)以及水蒸气反应而生锈,利用这一原理来达到食品防腐的目的。
-
(2) 探究问题二:该“双吸剂”是否变质?
甲同学:向固体中加入NaOH溶液。
乙同学:向固体中加入稀盐酸。
甲:(预想)如果观察到有红褐色的Fe(OH)3沉淀生成,则证明其已经变质。但是实验结果却没有出现沉淀,原因是NaOH溶液不能与反应。
乙:在实验开始时溶液就变成了黄色,此变化用化学方程式表示为。
[实验结论]乙同学用实验确定了这瓶“双吸剂”已经变质。
-
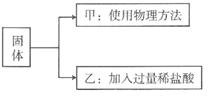
(3) 探究问题三:该“双吸剂”是否已经完全变质?
[设计实验]
[实验现象]
甲:甲的实验方法是。
乙:实验中看到了现象,此变化用化学方程式表示为。
[实验结论]甲、乙同学都用实验确定了这瓶“双吸剂”没有完全变质。
-
(4) [反思和评价]设计物质检验的实验时,要有明显的实验现象,例如实验室用澄清石灰水来检验二氧化碳而不用氢氧化钠溶液,原因是。
-
(1) Ⅰ.燃烧红磷法测定空气中氧气的含量。
甲组同学按照教材内容设计了如图1实验装置。

(实验原理)利用红磷在空气中燃烧生成五氧化二磷固体,集气瓶内压强减小,烧杯内水倒吸入集气瓶中。写出红磷在空气中燃烧的文字表达式。
-
(2) (实验步骤)
①用弹簧夹夹紧橡皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③待,打开止水夹,观察到的现象是;
④观察水倒流至集气瓶并记录水面的变化情况。
(实验结论)
多次实验发现,在实验操作完全规范下,集气瓶内上升的水面仍然始终小于理论值。
-
(3) (拓展研究)
查阅资料得知,当空气中氧气的体积分数降至约为7%以下时,红磷不再燃烧,由此可知,燃烧红磷法测定结果不够准确的原因的是。
-
(4) Ⅱ.探究某脱氧剂的成分(由两种物质组成)及利用该脱氧剂测定空气中氧气含量。
①探究脱氧剂成分。
(实验观察)脱氧剂为灰黑色粉末,若在空气中放置一段时间,有红棕色固体生成。
(实验猜想)根据颜色变化,猜想该脱氧剂中含有物质为。
-
(5) (验证猜想)用磁铁吸引,说明含有铁。
(实验探究)新取一定量的脱氧剂,将已验证的成分分离.取剩余固体与少量CuO混合,置于图2装置中加热(碳会与氧化铜反应生成CO2)。一会儿观察到澄清石灰水变浑浊。

(实验结论)该脱氧剂中还含有碳粉。
②测定空气中氧气含量。
使用图3装置进行实验,实验原理是利用脱氧剂中铁在常温下能够消耗装置内氧气,但实验前应先进行的操作是。
-
(6) (实验过程)
步骤1:在注射器中放入足量脱氧剂粉末,封闭;
步骤2:打开弹簧夹,将活塞向右拉至一定距离,关闭弹簧夹;
步骤3:不断轻轻晃动注射器,至活塞位置不再发生变化。
(数据处理)
①实验中需要记录的数据有(填字母)。
A 反应前注射器中原有空气的体积 B 反应后注射器中剩余气体的体积
②为减小误差,上述实验测定过程要重复多次,最终计算得出氧气约占空气的体积分数。
(实验评价)与燃烧红磷法相比,脱氧剂法测定空气中氧气含量的优点是。
-
(7) Ⅲ.由该实验该兴趣小组的同学们想到了实验室制取氧气并测定生成氧气体积的方法,进行如下试验:将一定量氯酸钾与适量二氧化锰混合,然后加热直至无气体放出,过一会儿读取进入量筒里的气体体积。试完成下列填空:

①若用图4来测量气体体积时,可以将装置A-B-C连接起来,此时应用乳胶管将装置A的导管口“a”与装置B的装置的(填“b”或“c”)管口相连;
②测量气体体积时,也可以将反应发生装置A直接和图5中的某一装置连接起来, 进行实验读数,则应该选用图5中的装置(填“A”或“B”),当实验结束时,应(填实验操作)。
(提出问题):该气体可能是什么呢?
(查阅资料)食品和氧气接触容易被氧化而腐败;常填充某种气体以防腐。
(作出假设)甲认为:可能是氧气 乙认为:可能是氮气 丙认为:可能是二氧化碳 丁认为:可能是氢气
-
(1) (分析讨论)小组同学经分析,一致认为甲的猜想不正确,理由是;从运输、贮存安全角度考虑,同学猜想也不可能,理由是,可能发生化学反应的化学方程式。
-
(2) (实验设计)为探究其余猜想,小组同学设计如下实验,请填写空白:
实验步骤
实验现象
实验结论
用注射器抽取袋内的气体,然后注入澄清石灰水
无明显变化
猜想正确
丙猜想正确
-
(3) (反思拓展)实验后,小组同学认为作为食品的防腐气体除化学性质不活泼、不与食品反应外,还应具备某些要求,你认为应该具备哪些要求? (答一点)
你认为:气体包装食品除防腐作用外,还可有作用。

资料:碳酸钠、氢氧化钠和偏铝酸钠溶解度随温度升高而升高,氢氧化钙溶解度随温度升高而降低。
-
(1) 晓进查阅资料并结合自己所学知识发现向发热包中加水依次发生下列反应:反应①(写化学方程式)该化合反应放热;反应②(写化学方程式);反应③
 , 该反应也放出大量热,生成的偏铝酸钠(NaAlO2)溶液呈碱性,NaAlO2属于(填“酸、碱、盐或者氧化物”)。
, 该反应也放出大量热,生成的偏铝酸钠(NaAlO2)溶液呈碱性,NaAlO2属于(填“酸、碱、盐或者氧化物”)。
-
(2) 晓进用数字化实验对发热包的注意事项展开研究:

①小心烫伤:晓进用温度传感器在专用饭盒内测得发热包加水后温度变化如图1所示,请分析500-1884秒内温度下降的可能原因。
②远离明火:远离明火原因(用化学方程式表示)。
③禁止食用:晓进利用温度传感器和pH传感器同时检测敞口环境下,同一反应体系中温度和pH随时间变化如图2所示。

在880-1856秒内随着温度的持续下降pH上升的原因是。由图2曲线可以证明反应后溶液碱性较强,有腐蚀性,且放出大量热,所以禁止食用。
④禁止热水:如果不小心加入热水,会使得自热米饭盒发生炸裂,请你从微观的角度分析饭盒炸裂的原因。
⑤我们使用发热包时要严格按照要求进行操作,未使用的发热包该如何保存。



