常见金属元素的单质及其化合物的综合应用 知识点题库
![]()
试回答:
-
(1) 若X是强氧化性单质,则A不可能是.
a.S b.N2 c.Na d.Mg e.Al
-
(2) 若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示).检验此C溶液中金属元素价态的操作方法是.
-
(3) 若A、B、C为含某金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为,X的化学式可能为(写出不同类物质)或.反应①的离子方程式为.
①FeCl3②FeCl2③CuCl2④MgCl2 .

①一定含有Zn ②一定含有Fe ③一定含有Cu ④可能含有Zn ⑤可能含有Fe ⑥可能含有Cu
-
(1) 碳酸氢钠俗称,其水溶液显性(酸,碱或中)。
-
(2) 碳酸氢钠可用于治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为。
-
(3) 铝及铝合金比较耐腐蚀,其耐腐蚀的原因是。
-
(4) 城防氢氧化钠溶液的玻璃试剂瓶不用玻璃塞,用化学方程式表示其中的原因
。
-
(5) 用化学方程式说明“酸性
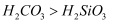 ” 。
” 。
-
(6) 用化学方程式说明“氧化性
 ”。
”。
-
(7) 不断搅拌的情况下,向盛有100mL 0.5
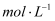
 溶液的烧杯中,逐滴滴入100mL0.5
溶液的烧杯中,逐滴滴入100mL0.5 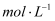 稀盐酸,整个过程中没有气泡产生,解释该实验现象的离子方程式是。
稀盐酸,整个过程中没有气泡产生,解释该实验现象的离子方程式是。
-
(8) 绿矾晶体(
 )加热,晶体先失去洁净水,继续高温强热还会发生分解反应:
)加热,晶体先失去洁净水,继续高温强热还会发生分解反应:  ,将少量混合气体通入
,将少量混合气体通入 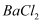 溶液中,产生白色沉淀的化学式是。
溶液中,产生白色沉淀的化学式是。
-
(1) 生石灰所属的物质类型为(填序号)
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥物
-
(2) 生石灰可作干燥剂的原因是(用化学方程式表示)。
-
(3) 你认为下列内容还必须在这种小纸袋上注明的是(用序号表示)
①禁止食用 ②可以食用 ③禁止未成年人用手拿 ④生产日期
 、
、  、
、  、
、  、
、  、
、  、
、  ,现取三份
,现取三份 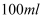 溶液进行如下实验:
溶液进行如下实验: ①第一份加入 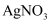 溶液有沉淀产生
溶液有沉淀产生
②第二份加足量  溶液加热后,收集到气体
溶液加热后,收集到气体 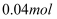
③第三份加足量  溶液后,得干燥沉淀
溶液后,得干燥沉淀 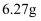 ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为  .根据上述实验,以下推测正确的是( )
.根据上述实验,以下推测正确的是( )
 一定存在
B .
一定存在
B . 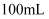 溶液中含
溶液中含  C . Cl-一定存在
D .
C . Cl-一定存在
D .  一定不存在,
一定不存在,  可能存在
可能存在
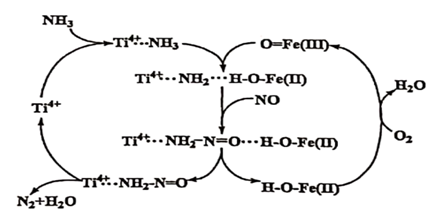
下列有关该历程的说法错误的是( )
 2N2+6H2O
B .
2N2+6H2O
B .  是中间产物
C .
是中间产物
C .  是催化剂
D .
是催化剂
D .  属于分解反应
属于分解反应
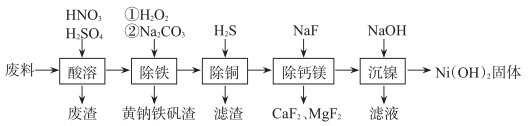
已知:H2S的电离常数K1=1.3×10-7 , K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6
回答下列问题:
-
(1) 合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,还原产物为N2 , 金属镍溶解的离子方程式是;“酸溶”时产生的废渣主要成分为。
-
(2) “除铁”加入Na2CO3时,生成黄钠铁矾(NaFe3(SO4)2(OH)6)的离子方程式是;“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾沉淀对后续操作较为有利,原因是。
-
(3) “除铜”时,反应的离子方程式为H2S+Cu2+=CuS↓+2H+ , 该反应平衡常数K=。
-
(4) “除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是。
-
(5) “沉镍”前c(Ni2+)=1.0mol/L,加入少量浓NaOH溶液,若忽略加入浓NaOH溶液对溶液体积的影响,则开始沉淀时溶液的pH=。
-
(6) 用含镍21%的100kg铁镍合金废料经上述工艺制得31kgNi(OH)2固体,镍的回收率为。
| 试管编号 | 1 | 2 | 3 | 4 |
| 滴加NaOH溶液的量 | 2滴 | 6滴 | 12滴 | 16滴 |
| 立即观察沉淀的颜色 | 浅绿色 | 浅绿色 | 蓝色 | 蓝色 |
| 酒精灯加热浊液后沉淀的颜色 | 浅绿色 | 浅绿色 | 黑色 | 黑色 |
取浅绿色沉淀用蒸馏水反复洗涤,加入稀盐酸完全溶解,再加入适量BaCl2溶液,产生大量白色沉淀。取蓝色沉淀重复上述实验,无白色沉淀。经检验,试管3、4中黑色沉淀中含有CuO。
下列说法错误的是( )
 CuO+H2O
D . 取浅绿色沉淀再滴加适量NaOH溶液后加热仍不会变黑
CuO+H2O
D . 取浅绿色沉淀再滴加适量NaOH溶液后加热仍不会变黑
 、
、 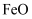 、
、  、
、  和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物:
和可燃性有机物,现利用下列工艺流程回收部分金属及金属化合物: 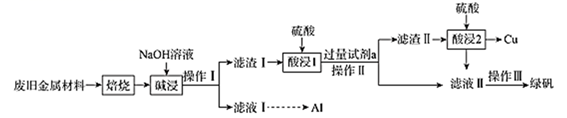
已知:绿矾为  。回答下列问题:
。回答下列问题:
-
(1) “焙烧”的目的是将金属单质转化为氧化物,并除去。
-
(2) NaOH的电子式为,“碱浸”时发生反应的固体为。
-
(3) “操作Ⅰ”的名称为。
-
(4) 试剂a为(填化学式),加入试剂a后可能发生的反应(写出其中1个反应的离子方程式即可)。
-
(5) 滤液Ⅱ中可能含有因氧气的作用而产生的少量(填离子符号),设计实验检验滤液Ⅱ中是否含有上述离子:。
-
(1) 钠的金属活动性比铝的(填“强”或“弱”)。
-
(2) 钠与水反应,观察不到的实验现象是(填编号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
-
(3)
 跟S在加热条件下反应,生成物的化学式为。
跟S在加热条件下反应,生成物的化学式为。
-
(4) 铁在高温时与水蒸气反应的化学方程式为。
-
(5) 将镁铝合金与过量NaOH溶液反应,所得溶液中不存在的离子是______。A . Na+ B . Mg2+ C . OH- D .

 Cl2
Cl2 FeCl2
B . NaClO(aq)
FeCl2
B . NaClO(aq) HClO(aq)
HClO(aq) HCl(aq)
C . HClO
HCl(aq)
C . HClO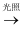 Cl2
Cl2 NaClO(aq)
D . 浓盐酸
NaClO(aq)
D . 浓盐酸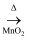 Cl2
Cl2 漂白粉
漂白粉
 ,含
,含  和
和  等杂质)为原料制备铝的一种工艺流程如图所示:
等杂质)为原料制备铝的一种工艺流程如图所示: 
注:  在“碱溶”时转化为铝硅酸钠沉淀。
在“碱溶”时转化为铝硅酸钠沉淀。
-
(1) 铝土矿“碱溶”时,氧化铝转化为进入溶液,提高铝土矿浸取速率的措施有(任答两点)。
-
(2) 向“过滤Ⅰ”所得滤液中加入
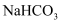 溶液,溶液的pH(填“增大”“减小”或“不变”),发生反应的离子方程式为。
溶液,溶液的pH(填“增大”“减小”或“不变”),发生反应的离子方程式为。
-
(3) “电解Ⅰ”是电解熔融的
 ,标准状况下每产生
,标准状况下每产生 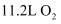 转移的电子数为。
转移的电子数为。
-
(4) “电解Ⅱ”是电解
 溶液,其原理如图所示,阳极的电极反应式为。
溶液,其原理如图所示,阳极的电极反应式为。 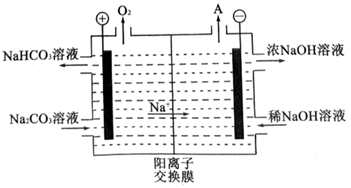
-
(1) 钠、铝、铁是三种重要的金属。请回答:
①将金属钠和铝粉同时投入水中,发生反应的离子方程式为、
②铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为。
③过量Fe跟
 在一定条件下反应,所得产物的名称是。将该产物溶于水配成溶液,分装在两支试管中。请回答:
在一定条件下反应,所得产物的名称是。将该产物溶于水配成溶液,分装在两支试管中。请回答:a.若向其中一支试管中滴加KSCN溶液,则溶液变成色。
b.向另一支试管中滴加NaOH溶液,现象为,反应的离子方程式是。
-
(2) 铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应。如:
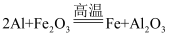 , 反应发生时放出大量的热。仔细阅读上述信息回答下列问题:
, 反应发生时放出大量的热。仔细阅读上述信息回答下列问题:①信息中的“某些”指(填“比铝活泼的”“比铝不活泼的”或“任意”)
②试写出铝粉与
 发生的铝热反应方程式。
发生的铝热反应方程式。
A B
B C
C
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁
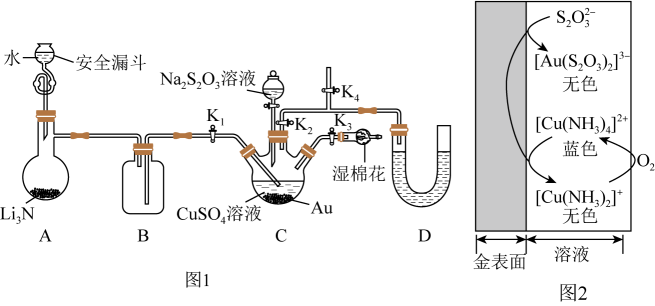
回答下列问题:
-
(1) 打开
 , 关闭
, 关闭 , 向A中烧瓶加水,制取
, 向A中烧瓶加水,制取 。安全漏斗的作用除加水外,还有,湿棉花的作用。
。安全漏斗的作用除加水外,还有,湿棉花的作用。
-
(2) 三颈瓶中蓝色沉淀消失后,关闭
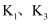 , 打开
, 打开 , 滴入
, 滴入 溶液。为使分液漏斗内的
溶液。为使分液漏斗内的 溶液顺利滴下,可将分液漏斗上部的玻璃塞打开或。根据图2原理可知,
溶液顺利滴下,可将分液漏斗上部的玻璃塞打开或。根据图2原理可知, 在浸金过程中起作用。三颈瓶中
在浸金过程中起作用。三颈瓶中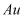 发生反应的离子方程式为。
发生反应的离子方程式为。
-
(3) 为了验证图2原理中
 的作用,进行如下实验:关闭
的作用,进行如下实验:关闭 , 反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈瓶中溶液蓝色变浅。然后(填操作和现象),对应反应的离子方程式是,此现象证实了上述原理中
, 反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈瓶中溶液蓝色变浅。然后(填操作和现象),对应反应的离子方程式是,此现象证实了上述原理中 的作用。
的作用。



