氯气的实验室制法 知识点题库
实验室制备Cl2 , 可以用下列三种方法:
①MnO2+4HCl(C) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(C)=2KCl+2MnCl2+5Cl2↑+8H2O
③KClO3+6HCl(C)=KCl+3Cl2↑+3H2O
如果分别用上述三种方法制得相同体积的Cl2 , 下列描述正确的是( )
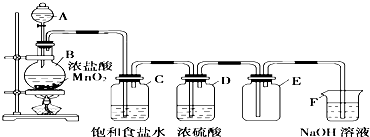
回答下列问题:
-
(1) 装置C的作用是,装置D的作用是.
-
(2) 装置F的作用是.
-
(3) 装置B中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl 的 物质的量为.
-
(4) 写出圆底烧瓶中发生的化学方程式:.
-
(5) F处发生反应的离子方程式为.
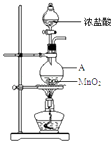
-
(1) 仪器A的名称为;A中反应的离子方程式为;
-
(2) 甲同学将A中产生的气体通入如表溶液:
实验序号
试剂
现象
a
紫色石蕊溶液
b
AgNO3溶液
出现白色沉淀
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
-
(3) 已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
-
(4) 已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04mol•L﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10mol•L﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10mol•L﹣1 AgNO3溶液的体积应大于 mL(用含V的代数式表示).

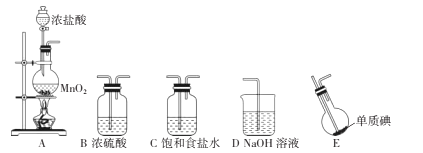
请回答下列问题:
-
(1) 装置F中发生反应的离子方程式为.
-
(2) 甲、乙两同学分别采用下列两种方案制取Cl2:甲:用含HCl 146g的浓盐酸与足量的MnO2反应.乙:用87g MnO2与足量浓盐酸反应.则所得氯气(填字母).
a.甲比乙多b.乙比甲多c.一样多
-
(3) 仪器H的名称是(填名称),装置E的作用是.
-
(4) 装置C的导管G处逸出的尾气中可能含有黄绿色的有毒气体,可用进行尾气处理(填选用试剂的名称).
![]()
-
(1) 检查A装置气密性的方法为。
-
(2) 上述装置,按气流方向连接的顺序为(装置可重复使用),A中发生反应的离子方程式为。
-
(3) C装置的作用是。
-
(4) E装置的烧瓶反应时需放在水中,控制温度大约40℃,其目的是。
-
(5) 按上述连接好的装置进行实验,实验步骤如下:
①检查装置气密性后,装入药品 ②打开分液漏斗活塞 ③关闭分液漏斗活塞 ④停止加热E,充分冷却 ⑤水浴加热E
请按符合题意的顺序填入上述步骤的序号。
-
(6) 在A装置后可连接如图的装置,当反应结束关闭分液漏斗活塞后,关闭K,该装置的作用是。

-
(7) ICl和水反应的化学方程式为。
 B . 实验室制氢气
B . 实验室制氢气  C . 实验室制氯气
C . 实验室制氯气  D . 实验室过滤操作
D . 实验室过滤操作 
已知:①AlCl3、FeCl3分别在183 ℃、315 ℃时升华;②无水AlCl3遇潮湿空气变质。
-
(1) Ⅰ. 实验室可用下列装置制备无水AlCl3。

组装好仪器后,首先应,具体操作为
-
(2) 装置 B中盛放饱和NaCl溶液,该装置的主要作用是。装置C中盛放的试剂是。装置F中试剂的作用是。若用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为
-
(3) 将所制得的无水AlCl3配制溶液时需加入盐酸的目的是
-
(4) Ⅱ. 工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:

氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为
-
(5) 700 ℃时,升华器中物质充分反应后降温实现FeCl3和AlCl3的分离。温度范围应为
a.低于183 ℃ b .介于183 ℃和315 ℃之间
c.高于315 ℃
-
(6) 样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。

计算该样品中AlCl3的质量分数(结果用m、n表示,不必化简)。
 装置用于实验室制备氯气
B .
装置用于实验室制备氯气
B . 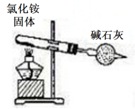 装置实验室制氨气
C .
装置实验室制氨气
C . 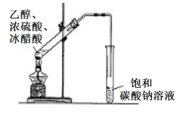 装置用于实验室制乙酸乙酯
D .
装置用于实验室制乙酸乙酯
D . 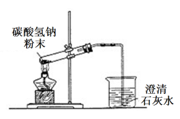 装置可进行碳酸氢钠受热分解
装置可进行碳酸氢钠受热分解
-
(1) 化学与生产生活密切相关,请写出下列反应
①实验室制氯气(离子方程式)
②“腐蚀法”制作印刷电路板(化学方程式)并用双线桥表示该反应的电子转移数目和方向
-
(2) K2FeO4可用作水处理剂,它可由以下反应制得:
Cl2 + Fe(OH)3 + OH- = FeO4 2-+ Cl- + H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为

-
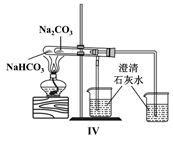
(1) 装置的连接顺序为a→→→→→b→c→f。
-
(2) 硬质玻璃管与收集器之间没有用导管连接,这样做的优点是。
-
(3) 反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

试剂X中溶质的化学式为;固体产物的成分可能为(填字母)。
A.Fe和FeCl3
B.FeCl2 和FeCl3
C.Fe、FeCl2和FeCl3
D.Fe和FeCl2
-
(4) 加入少许植物油的作用是,加入新制氯水后溶液红色加深的原因:(用离子方程式表示)。
-
(5) 现有一含FeCl2和FeCl3混合物的样品,用离子交换法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为。(计算结果保留两位有效数字)
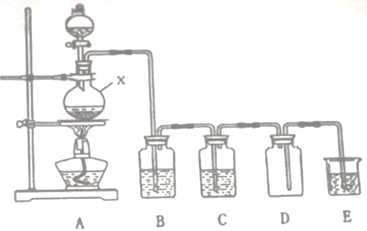
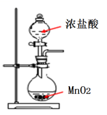
请完成下列空白。
-
(1) 仪器X中发生反应的离子方程式为。
-
(2) 装置B中的试剂是,装置C作用是。
-
(3) 装置D中的错误为。
-
(4) 装置E中的试剂为。
-
(5) 加热150m12mol/L HCl溶液和3.48g MnO2粉末的混合物,若反应充分进行,则理论上可产生的Cl2在标准状况下的体积为mL。
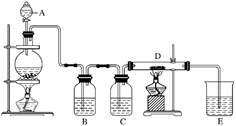
-
(1) 仪器A的名称是,烧瓶中反应的化学方程式是。
-
(2) 装置B中盛放液体是,气体通过装置B的目的是。
装置C中盛放的液体是,气体通过装置C的目的是。
-
(3) D中反应的化学方程式是。
-
(4) 烧杯E中盛放的液体是,反应的化学方程式是。
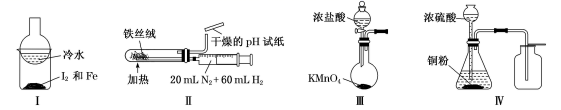
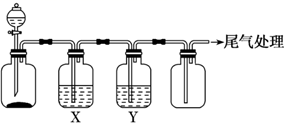
| 选项 | 实验目的 | X中试剂 | Y中试剂 |
| A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
| B | 用Na2SO3与浓盐酸制取并收集纯净干燥的SO2 | 饱和NaHSO3溶液 | 浓硫酸 |
| C | 用Zn粒和稀盐酸制取并收集纯净干燥的H2 | NaOH溶液 | 浓硫酸 |
| D | 用FeS固体和稀盐酸制取并收集纯净干燥的H2S | 饱和NaHS溶液 | 浓硫酸 |

-
(1) 指出上述图中的各处不正确:
①;
②;
③;
④。
-
(2) 在改进后的装置中,饱和食盐水的作用是。
-
(3) 如果将过量二氧化锰与含HCl8.76g的浓盐酸混合加热,充分反应后生成的氯气明显少于4.26g。为提高浓盐酸的利用率,你对实验的建议是。
-
(4) 圆底烧瓶中发生反应的离子方程式是,氧化剂是。
-
(5) 实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可向烧瓶中加入的溶液是。
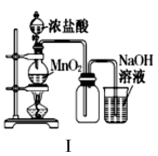

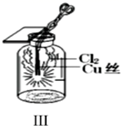

-
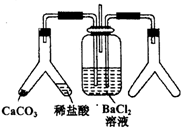
(1) A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式:。
-
(2) E中为红色干布条,F中为红色湿布条,可观察到的现象是。对比E和F中现象的差异可得出的结论及解释是。
-
(3) 试管C中试剂为。
-
(4) 装置G处发生反应的离子方程式为。
-
(5) 用离子方程式表示试剂X的作用:。
-
(6) 家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如图。
注意事项:
①本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
②密封保存,请勿与洁厕灵同时使用。
③保质期为一年。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:。




