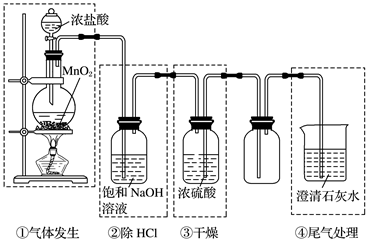
氯气的实验室制法 知识点题库
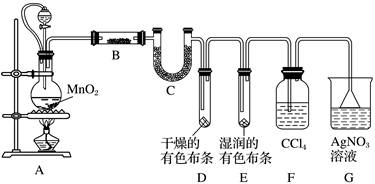
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

-
(1) 制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:.
-
(2) 装置B中饱和食盐水的作用是;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象.
-
(3) 装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入.
a
b
c
d
I
干燥的有色布条
干燥的有色布条
湿润的有色布条
湿润的有色布条
II
碱石灰
硅胶
浓硫酸
无水氯化钙
III
湿润的有色布条
湿润的有色布条
干燥的有色布条
干燥的有色布条
-
(4) 设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为色,说明氯的非金属性大于溴.
-
(5) 打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是.
-
(6) 有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:,判断改用NaHSO3溶液是否可行(填“是”或“否”).

-
(1) 装置A中的反应为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中氧化剂和还原剂的物质的量之比是,生成71g Cl2时反应转移的电子是 mol,装置C中生成SO2 , 反应的化学方程式是
-
(2) 装置B中蘸有NaOH溶液的棉花的作用是
-
(3) SO2与Cl2同时通入水中反应的化学方程式是.
 5Cl﹣+ClO3﹣+3H2O,请回答下列问题:
5Cl﹣+ClO3﹣+3H2O,请回答下列问题: 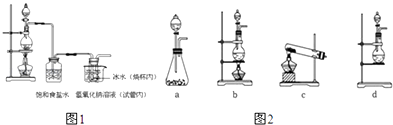
-
(1) 连接好装置,装药品之前,必须进行的一项操作步骤是.
-
(2) 圆底烧瓶内发生反应的化学方程式为;大试管内发生反应的离子方程式为.
-
(3) 饱和食盐水的作用是;冰水的作用是.
-
(4) 在制取Cl2时,实验室中若无MnO2 , 可用KMnO4粉末代替,发生下列反应:
2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,则可选择的发生装置是(填序号).

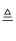 Cl2↑+Mn2++2H2O
C . 新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+ , 后者可抑制Fe2+的水解
D . 若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子
Cl2↑+Mn2++2H2O
C . 新配制的F溶液一般需要加入铁屑和稀盐酸,前者用于防止Fe2+被空气氧化成Fe3+ , 后者可抑制Fe2+的水解
D . 若反应①在常温下进行,则1 mol A在反应中能转移1 mol电子
Ⅰ.Cl2的制备
-
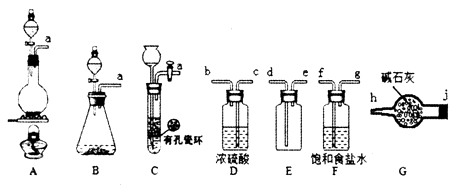
(1) Cl2的发生装置可以选择上图中的(填大写字母),反应的离子方程式为.
-
(2) 欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a
 (按气流方向,用小写字母表示)。
(按气流方向,用小写字母表示)。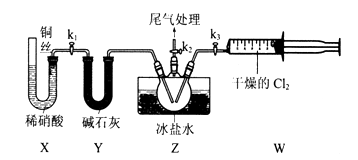
-
(3) Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
实验室也可用B装置制备NO,与之相比X装置的优点为.
-
(4) 在检查完装置气密性,并装入药品后,打开k2,然后再打开(填“k1”"或“k3”),通入一段时间气体,其目的为。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
-
(5) Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
亚硝酰氯(ClNO)与水反应的化学方程式为.
-
(6) 亚硝酰氯(ClNO)的质量分数为(用代数式表示即可)。

-
(1) 装置A中发生反应的化学方程式为;
-
(2) 装置E中盛装的溶液是;
-
(3) 装置B能否用装置D替换,原因是;
-
(4) 装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式,在标准状况下,448 mL NH3参加反应,则转移的电子数为。(用NA代表阿伏加德罗常数)

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4 ,
易溶于水、微溶于浓KOH溶液,在0~5℃的强碱性溶液中较稳定。回答下列问题:
-
(1) 仪器a的名称是 ,装置C中三颈烧瓶置于冰水浴中的目的是。
-
(2) 装置B吸收的气体是(写化学式),装置D的作用是。
-
(3) 装置C中得到足量KClO后,将三颈烧瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),反应的离子方程式为。再加入饱和KOH溶液,析出暗紫色晶体,过滤,得到K2FeO4粗产品。
-
(4) K2FeO4粗产品中含有Fe(NO)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
-
(5) 测定K2FeO4产品纯度。称取K2FeO4产品0.2100g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250mL溶液,取出25.00mL溶液放入锥形瓶中,用0.01000mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00mL[已知:Cr(OH)
 +FeO
+FeO  =Fe(OH)3↓+CrO
=Fe(OH)3↓+CrO  +OH- , 2CrO
+OH- , 2CrO  +2H+=Cr2O
+2H+=Cr2O  +H2O,Cr2O
+H2O,Cr2O  +6Fe2++14H+=6Fe3++2Cr3++7H2O]。则K2FeO4产品的纯度为 %(保留1位小数)。
+6Fe2++14H+=6Fe3++2Cr3++7H2O]。则K2FeO4产品的纯度为 %(保留1位小数)。
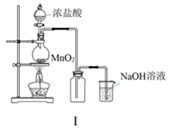 图I:若MnO2过量,则浓盐酸就可全部消耗
B .
图I:若MnO2过量,则浓盐酸就可全部消耗
B . 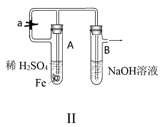 图Ⅱ:可利用该装置制备Fe(OH)2并较长时间保持颜色不变
C .
图Ⅱ:可利用该装置制备Fe(OH)2并较长时间保持颜色不变
C . 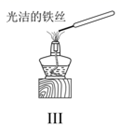 图Ⅲ:可利用该实验直接观察纯碱中钠元素的焰色反应
D .
图Ⅲ:可利用该实验直接观察纯碱中钠元素的焰色反应
D . 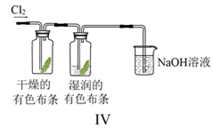 图Ⅳ:利用该实验装置可证明起漂白作用的不是Cl2
图Ⅳ:利用该实验装置可证明起漂白作用的不是Cl2
请回答下列问题:
-
(1) 装置A中连接橡皮管的目的是。
-
(2) 装置A中发生反应的离子方程式为。装置B中盛放的试剂是。
-
(3) 有同学基于实验的严谨性考虑,认为可在F、G两个装置之间再加一个装有湿润的淀粉KI试纸的装置,其目的是。
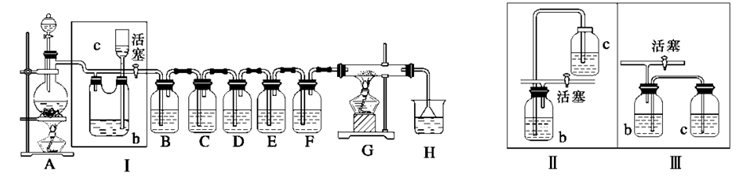
-
(1) A是氯气发生装置,其化学反应方程式是。
-
(2) I中b瓶内加入的液体最好是。
-
(3) 用图示的II可代替I,但III不可以,请简要说明理由。
-
(4) 实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和I处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①凭什么实验现象证明氯气已充满了整个装置。
②下列装置中的现象是C;D;E;F。
-
(5) G装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出G中反应的化学方程式:。
-
(6) 在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。
 MnCl2+Cl2↑+2H2O。关于该反应的说法正确的是( )
MnCl2+Cl2↑+2H2O。关于该反应的说法正确的是( )
-
(1) I.熔融制K2MnO4
将MnO2固体与KOH固体混合加热熔融得到K2MnO4 , 化学方程式是。
-
(2) 该步骤需要在(填仪器名称)中熔融,同时还需要用到的仪器是(填序号)。
A.
 B.
B.  C.
C.  D.
D.  E.
E. 
-
(3) II.Cl2氧化制备KMnO4
已知:K2MnO4在酸性或者中性的水溶液中易歧化
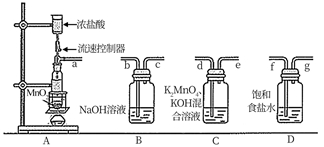
A中使用油浴加热的优点是。
-
(4) 连接装置:顺序为a→→→→→→ (按气流方向,用小写字母表示);操作为:连接装置,,打开流速控制器。
-
(5) 该实验需严格控制A中浓盐酸流速,若过快,产生的不利后果是。
-
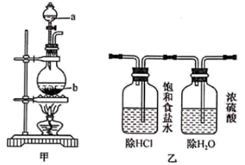
(1) 写出装置甲中发生反应的化学方程式:。装置甲中的仪器使用前需要检漏的有(写名称)。
-
(2) 利用装置丙制取饱和氯水并测其pH。
①证明氯水已饱和的现象是。
②若撤去装置乙,直接将装置甲和丙相连,这样做对实验测定结果的影响是。
-
(3) 饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
ⅰ.在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
ⅱ.过滤,将滤液滴在有色布条上,发现其漂白性更强;
ⅲ.为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀。
第二份与稀盐酸混合,立刻产生大量气泡。
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
①试根据所学知识推测,在ii的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)。
②写出步骤iii中第一份滤液发生反应的离子方程式:。
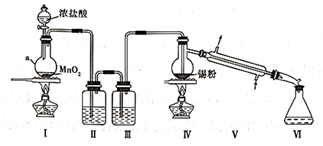
已知:①锡的熔点232℃、沸点2260℃;②SnCl2的熔点246.8℃、沸点623℃;③SnCl4的熔点-33℃、沸点114℃,SnCl4极易水解。通常将SnCl4晶体加入浓盐酸中,以配制无色的SnCl4溶液。回答以下问题
-
(1) 仪器a的名称为,该仪器中发生反应的离子方程式为。
-
(2) 装置Ⅱ的作用是,如果去掉装置Ⅱ,从实验安全的角度看可能产生的影响是。
-
(3) 装置Ⅲ中的试剂为。下图中可替代装置Ⅲ的是(填字母序号,下同)。
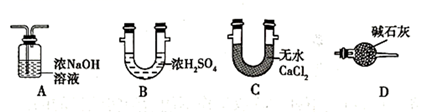
-
(4) 该实验装置存在一处明显的缺陷,改进方法为在装置Ⅵ后连接上图中的。
-
(5) 若反应中消耗17.85g锡粉可得到37.2g SnCl4 , 则SnCl4的产率为(保留三位有效数字)
 和
和 , 探究其氧化还原性质。
, 探究其氧化还原性质。
回答下列问题:
-
(1) 盛放浓盐酸的仪器名称是,a中的试剂为。
-
(2) c中化学反应的离子方程式是。采用冰水浴冷却的目的是。
-
(3) 反应结束后,取出b中试管,经冷却结晶,过滤,洗涤,干燥,得到
 晶体。沉淀过滤后,洗涤的操作方法是。
晶体。沉淀过滤后,洗涤的操作方法是。
-
(4) 取少量
 和
和 溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色。可知该条件下
溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色。可知该条件下 的氧化能力
的氧化能力 (填“大于”或“小于”)。
(填“大于”或“小于”)。
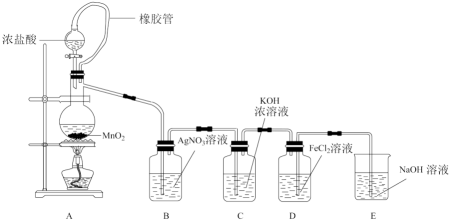
请回答下列问题:
-
(1) 装置A中制取Cl2的离子反应方程式为。
-
(2) 装置B中溶液出现浑浊,能否说明Cl2与AgNO3溶液发生反应?请说明理由。
-
(3) 装置C中制取氯酸钾的化学方程式为:
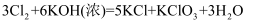 , 该反应中氧化剂为,还原剂为。
, 该反应中氧化剂为,还原剂为。
-
(4) 装置D中导管接错,若导致溶液进入装置E,则E中出现的现象为。
-
(5) 装置D导管符合题意连接后,装置E中仍然有一处明显不符合题意,请指出。

-
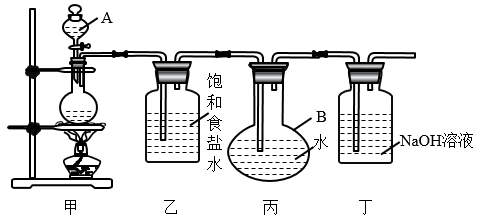
(1) 写出装置Ⅰ中发生反应的离子方程式。
-
(2) 装置Ⅱ的作用是。装置Ⅳ的作用是。
-
(3) 装置Ⅲ中盛放的试剂为。
-
(4) 装置Ⅵ中发生反应的离子方程式为。
-
(5) 装置Ⅴ和装置Ⅵ的位置(填“能”或“不能”)颠倒,原因。



