氯气的实验室制法 知识点题库
 2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置:
2CaSO4+2Cl2↑+2H2O,他们设计了如图1所示的制取氯气并验证其性质的实验装置: 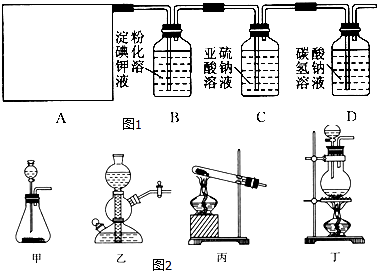
请回答下列问题:
-
(1) 该实验中A部分的装置是图2中的.
-
(2) A中发生反应一段时间后,B中的现象是.
B中发生反应的化学方程式为.
整套实验装置存在的明显缺陷是.
-
(3) 写出D装置中发生反应的离子方程式.
-
(4) 请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化为Na2SO4(简述实验步骤):.

-
(1) B中反应的化学方程式为:;
-
(2) D中的反应开始前,需排除装置中的空气,应采取的方法是:.
-
(3) D中反应化学方程式为:.
-
(4) 装置(Ⅰ)的主要缺点是:.
-
(5) 装置(Ⅱ)的主要缺点是:.如果选用此装置来完成实验,则必须采取的改进措施是:.
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取漂白粉,据此回答下列问题:
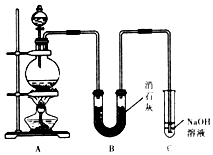
-
(1) 在A装置中用固体二氧化锰与浓盐酸在加热条件下制取氯气,反应的化学方程式 .
-
(2) 漂白粉将在U形管中产生,其化学方程式是
-
(3) C装置的作用是.
-
(4) 家庭中使用漂白粉时,为了增强漂白能力,可加入少量的物质是 .A . 食盐 B . 纯碱 C . 烧碱 D . 食醋.

-
(1) A仪器的名称是,D的作用。
-
(2) 漂白粉将在U型管中产生,其反应的化学方程式是。
-
(3) 此实验结果所得Ca(ClO)2产率太低。经分析并查阅资料发现主要原因是在U型管中存在两个副反应:
①温度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是,有同学测出了反应后溶液中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为上图(不考虑氯气和水的反应)。
a、图中曲线I表示离子的物质的量随反应时间变化的关系。
b、所取石灰乳中含有Ca(OH)2的物质的量为mol。
②试判断另一个副反应是(写出此反应方程式),为避免此副反应发生,可采取的措施是
-
(1) [实验一]氯气的制取
该小组拟用下图实验装置来制备纯净、干燥的氯气,并完成与金属铁的反应(夹持仪器略去,下同)。每个虚线框表示一个单元装置,请用文字描述将下列装置的不符合题意之处改正。
-
(2) [实验二]探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应,12FeCl2+3O2
 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2  2Fe2O3+4Cl2 , 该化学小组选用下图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2 , 该化学小组选用下图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
实验装置的合理连接顺序为:A→→E。
-
(3) 假设加热装置中的完全反应,则反应后剩余固体的化学式是。请设计实验方案验证你的假设。
-
(4) 简述将F中的固体配成溶液的操作方法。
-
(5) [实验三]卤素化合物之间反应实验条件控制探究
在不同实验条件下KClO3可将KI 氧化为I2 或KIO3。下面是该小组设计的一组实验数据记录表(实验控制在室温下进行):
试管标号
1
2
3
4
0.20 mol· L-1KI 溶液/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0. 10
0. 10
0.10
0.10
6.0 mol· L-1 H2SO4溶液/mL
0
3.0
6.0
9.0
蒸馏水/mL
9.0
6.0
3.0
0
实验现象
①该组实验的目的是。
②2号试管反应完全后,取少量2号试管中的溶液滴加淀粉溶液后显蓝色,假设还原产物只有KCl,写出反应的离子方程式。
-
(1) Ⅰ.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4 , 主要流程如下:

写出AlCl3与氨水反应的化学反应方程式 。
-
(2) 判断流程中沉淀是否洗净的方法是,高温焙烧时,用于盛放固体的仪器名称是。
-
(3) Ⅱ.无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
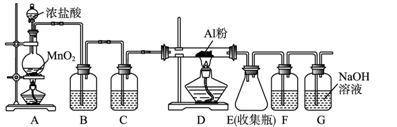
其中装置A用来制备氯气,写出其化学反应方程式。
-
(4) 装置B中盛放饱和NaCl溶液,该装置的主要作用是。
-
(5) F中试剂是。G为尾气处理装置,其中反应的离子方程式:。
-
(6) 制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案(填“可行”,“不可行”),理由是。

a为浓盐酸,b为MnO2 , c为饱和食盐水, d为30%KOH溶液,e为NaOH溶液
回答下列问题:
-
(1) 检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I中反应的化学方程式为 。
②若取消装置II,对本实验的影响是 。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和。
-
(2) 为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10, 滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去ClO-的离子方程式是。
②样品中KClO3的貭量分数为。(保留三位有效数字,KClO3式量:122.5)
| 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 化学性质 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2 (少量) 2PCl3 2PCl32P+5Cl2 (过量)  2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO4和HCl,遇氧气生成POCl3 |
-
(1) I.PCl3的制备
如图是实验室制备PCl3的装置(部分仪器已省略)。

回答下列问题:
仪器乙的名称是;与自来水进水管连接的接口编号是 (填“a”或“b”)。
-
(2) 实验前需先向仪器甲中通入一段时间CO2 , 然后加热,再通入干燥Cl2。干燥管中碱石灰的作用主要是:①;②。
-
(3) 实验室制备Cl2的离子方程式为;实验过程中,通入氯气的速率不宜过快的原因是。
-
(4) II.测定PCl3的纯度
测定产品中PCl3纯度的方法如下:迅速称取4.100g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量0.1000 mol·L-1 20.00 mL碘溶液,充分反应后再用0.1000 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NAI+Na2S4O6 , 假设测定过程中没有其它反应。
根据上述数据,该产品中PCl3的质量分数为;若滴定终点时仰视读数,则PCl3的质量分数(填“偏大”、“偏小”或“无影响”)。
-
(5) III.PCl3水解生成的H3PO3性质探究
请你设计一个实验方案,证明H3PO3为二元酸:。
-
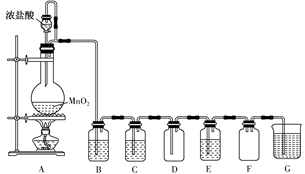
(1) 圆底烧瓶中发生反应的化学方程式为。
-
(2) 若要得到干燥纯净的气体,则B中应盛放的试剂是,作用是;C中应盛放的试剂是,作用是。
-
(3) E中若装有淀粉KI溶液,能观察到的实验现象是。
-
(4) Cl2的密度比空气,且(填“能”或“不能”)溶于水,难溶于饱和食盐水,因此可用法或排饱和食盐水法收集。
-
(5) G中的试剂可为。
 NaClO3+5NaCl+3H2O,并设计如图制备NaClO溶液的装置:
NaClO3+5NaCl+3H2O,并设计如图制备NaClO溶液的装置: 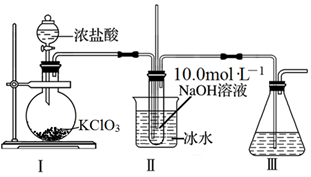
-
(1) 装置Ⅰ中烧瓶内发生反应的化学方程式为。
-
(2) 装置Ⅱ中用冰水浴控制温度的目的是;装置Ⅲ的作用是。
-
(3) 上述装置存在一处缺陷,会导致NaClO产率降低,改进的方法是。
-
(4) 用NaOH固体配制480mL10.0mol·L-1的NaOH溶液时,所需玻璃仪器除量筒、烧杯、胶头滴管外还需要。
-
(5) 配制上述NaOH溶液时,将称量好的NaOH固体g放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容会导致结果(填“偏大”、“不变”或“偏小”)。配制溶液的过程中定容时的操作是。
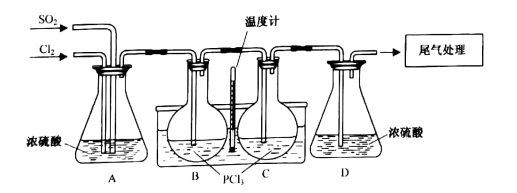
已知:
| 名称 | 熔点/℃ | 沸点/℃ | 溶解性 | 理化性质 |
| 三氯氧磷 | 2 | 105.3 | 可溶于有机溶剂 | 遇水分解 |
| 氯化亚砜 | -105 | 78.8 | 可溶于有机溶剂 | 遇水分解,加热分解 |
-
(1) 实验室制备氯气或二氧化硫时均可能用到的仪器有_______。A . 温度计 B . 酒精灯 C . 分液漏斗 D . 圆底烧瓶
-
(2) A装置的作用为:、、使气体充分混合。
-
(3) 实验开始时需水浴加热,一段时间后改为冷水浴,其原因是。
-
(4) B中发生反应的化学方程式是。
-
(5) 反应5~6小时后,暂停通入气体。将B瓶拆下,C瓶装在图中B瓶处,并在原C瓶处重新装上一个盛有PCl3的圆底烧瓶。继续通气反应一段时间后重复以上步骤,上述操作的优点是;B瓶中的物质可采用.(填实验方法)使其分离。
-
(6) 已知反应前加入三氯化磷550g,最终得到357g氯化亚砜,则三氯氧磷的产率为。
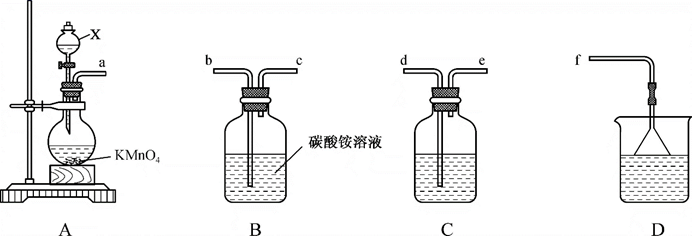
回答下列问题:
-
(1) 装置A中仪器X的名称是,盛放的试剂是,装置A中发生反应的离子方程式为。
-
(2) 整个装置的导管连接顺序为a→→→→→。
-
(3) 装置B中发生反应的化学方程式为。
-
(4) 装置C的作用为。装置D的作用为。
-
(5) 三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._ Na2SO3+_ NCl3 +_=_Na2SO4 +_ HCl+ _NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:
②装置B反应后的溶液中三氯化氮的浓度为mol·L-1。

请回答下列问题:
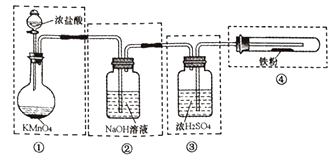
-
(1) 盛放浓盐酸的仪器名称是。
-
(2) B中选用的试剂是,其作用是,E中选用的试剂是,其作用是。
-
(3) D中反应的化学方程式是:。
-
(4) A中制取氯气的离子方程式是:。
-
(1) 写出高氯酸的化学式。
-
(2) 写出中子数为1的氦原子符号。
-
(3) 写出氯酸钾在水溶液中的电离方程式。
-
(4) 写出实验室制备氯气的化学方程式。
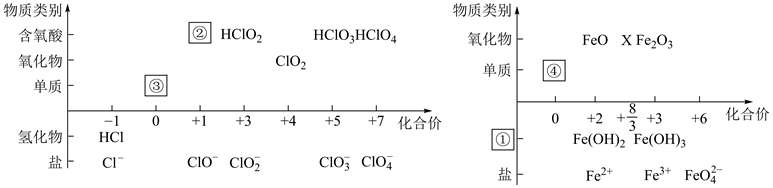
-
(1) 价-类二维图中①、②处应分别填、。
-
(2) 从物质分类角度分析,实验室常用的制取③的化学方程式为;物质的量均为1mol的③和④充分反应转移电子数为。
-
(3) 从化合价角度看,
 具有(填字母序号),并由此写出
具有(填字母序号),并由此写出  与NaOH反应生成等物质的量的氧化产物与还原产物的离子方程式:。
与NaOH反应生成等物质的量的氧化产物与还原产物的离子方程式:。 A.氧化性 B.还原性 C.既有氧化性、又有还原性
-
(4) 聚合碱式氯化铝铁[
 ]即PAFC是一种新型的无机高分子絮凝剂。配料主要成分:
]即PAFC是一种新型的无机高分子絮凝剂。配料主要成分:  、
、  、FeO、
、FeO、  等,制取PAFC的实验流程如下,“聚合”过程的离子方程式为:。
等,制取PAFC的实验流程如下,“聚合”过程的离子方程式为:。 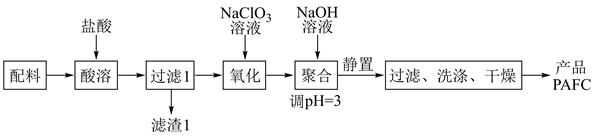

-
(1) A中盛有浓盐酸,B中盛有MnO2 , 写出反应的离子方程式:。
-
(2) E中为红色干布条,F中为红色湿布条,可观察到的现象是。对比E和F中现象的差异可得出的结论及解释是。
-
(3) 试管C和D中试剂各为。
-
(4) 装置G处发生反应的离子方程式为。
-
(5) 用离子方程式表示试剂X的作用:。
-
(6) 家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
注意事项:
1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2.密封保存,请勿与洁厕灵同时使用。
3.保质期为一年
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:。
-
(1) 如图为氯及化合物的“价-类”二维图。物质A为、物质B为(填化学式)。

-
(2) 1774年,舍勒制得
 , 请写出实验室制取氯气的化学方程式。
, 请写出实验室制取氯气的化学方程式。
-
(3) HOF与HClO结构相似,写出HOF的电子式。但HOF更不稳定,更易分解,其反应为
 , 该反应属于。
, 该反应属于。A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应
-
(4)
 与
与 均能用于自来水消毒。标准状况下,
均能用于自来水消毒。标准状况下, 和
和 组成的混合气体的密度为
组成的混合气体的密度为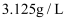 , 则混合气体的摩尔质量为
, 则混合气体的摩尔质量为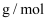 , 混合气体中
, 混合气体中 的体积分数为(用分数表示)。
的体积分数为(用分数表示)。



