高中 化学
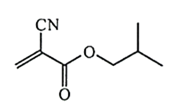
 来表示,下列说法正确的是( )
来表示,下列说法正确的是( )
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M,N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H2O(冷水)═Z(OH)2+H2↑;
④水溶液中,X+Y2+═X2++Y.
则这五种金属的活动性由强到弱的顺序为( )
-
(1) 将生产的煤直接进行燃烧,造成环境污染之一是形成硝酸型酸雨。以下是对硝酸型酸雨的评价,其中正确的是(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生态系统
b.对电线、铁轨、桥梁、房屋等均会造成损害
c.破坏臭氧层
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥
-
(2) 如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图:
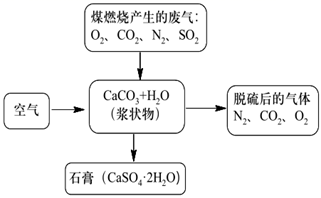
请回答下列问题。
①脱硫以后,在废气中含量明显增加的气体是(写化学式),它对环境的负面影响是。
②检验脱硫后废气中是否含有SO2的简单方法是。
③写出在废气脱硫并形成副产物(CaSO4·2H2O)的过程中所发生主要反应的化学方程式。
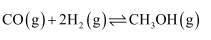
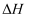
回答下列问题:
-
(1) 该反应的能量变化如图Ⅰ所示,反应的
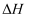 =,曲线(填“a”或“b”)表示使用了催化剂。
=,曲线(填“a”或“b”)表示使用了催化剂。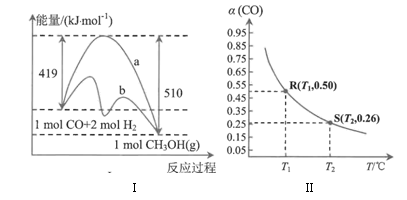
-
(2) 下列措施既能加快反应速率,又能提高CO转化率的是____,A . 升高温度 B . 增大压强 C . 降低温度 D . 增加
 投料量
投料量
-
(3) 相同温度下,若已知反应
 的平衡常数为
的平衡常数为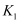 , 反应
, 反应 的平衡常数为
的平衡常数为 , 则反应
, 则反应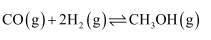 的化学平衡常数
的化学平衡常数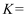 (用含
(用含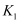 和
和 的代数式表示)。
的代数式表示)。
-
(4) 在恒温恒容密闭容器中按
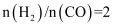 加入反应起始物
加入反应起始物Ⅰ.下列描述不能说明反应达到平衡状态的是。
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与
 的浓度相等 D.容器内CO的体积分数不再变化
的浓度相等 D.容器内CO的体积分数不再变化Ⅱ.若CO的平衡转化率[
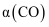 ]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:
]随温度的变化曲线如图Ⅱ所示,R、S两点平衡常数大小:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。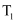 温度下,测得起始压强
温度下,测得起始压强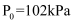 , 达平衡时
, 达平衡时 kPa(
kPa( ×物质的量分数)。
×物质的量分数)。
2011年央视3·15特别节目《“健美猪”真相》的报道,将我国最大肉制品加工企业双汇集团卷入“瘦肉精”漩涡之中。盐酸克伦特罗(即瘦肉精的一种)学名7 – [2 – 甲基丙烷 – 2 – 亚氯基 – 甲基] – 4 – 氨基 – 3,5 – 二氯苯甲醇盐酸盐,是白色或类白色的结晶粉末,无臭,熔点161℃,微溶于丙酮,不溶于乙醚;其结构简式如右。则下列有关说法正确的是 ( )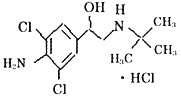
①强度高 ②质量轻 ③耐高温 ④耐腐蚀
下列说法正确的是
A. 用冰醋酸、蒸馏水和容量瓶等可以配制pH=1的醋酸溶液
B. 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大
C. 反应SiO2(s)+ 3C(s)="SiC(s)" + 2CO(g)室温下不能自发进行,则该反应的△H<0
D. 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小
用50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
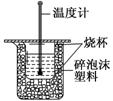
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__。碎泡沫塑料的作用是__。
(2)大烧杯上如不盖硬纸板,求得的中和热数值__(填“偏大”“偏小”或“无影响”)。
(3)如果用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”或“不相等”),所求中和热__(填“相等”或“不相等”),简述理由:__。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会__(填“偏大”“偏小”或“无影响”)。
把一小块金属钠暴露在空气中,观察到以下现象:①金属钠表面逐渐变暗;②过一段时间以后又逐渐变潮湿;③再过些时候又转变成白色固体;④又过一段时间白色固体变成白色粉末。写出以上发生的各种现象的有关化学方程式。
计算填空:
(1)25.2 g Na2RO3含Na+ 0.4 mol, R的相对原子质量为__________。含R的质量为1.6 g的Na2RO3,其物质的量为__________。
(2)A物质按下式分解:2A===B↑+2C↑+2D↑,测得生成的混合气体在相同条件下的密度是H2密度的m倍,则A的摩尔质量为__________。
(3)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是____________L(用含NA的式子表示)。
(4)现有0.1 mol·L-1 Na2SO4和0.1 mol·L-1 H2SO4的混合溶液100 mL,向其中逐滴加入 0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
①当加入50 mL Ba(OH)2溶液时,所得溶液中的溶质是________
②当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为________mL,所得溶液中溶质为________,则该溶质物质的量浓度为________ 。
下列物质性质和应用的对应关系正确的是:
A.84消毒液具有碱性,可用作消毒剂和漂白剂
B.氢氟酸具有酸性,可用于玻璃的腐蚀剂
C.过氧化钠具有漂白性,可作航空和潜水的供氧剂
D.活性铁粉具有还原性,在食品袋中可用作除氧剂
W、X、Y、Z、Q是原子序数依次增大的前四周期元素,W是宇宙中最丰富的元素;X、Z元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有2个未成对电子;向含有 QSO4的溶液中滴加氨水,生成蓝色沉淀,继续滴加氨水,沉淀溶解,得深蓝色溶液。请回答下列问题:
(1)Y元素在周期表中的位置为 ,第一电离能Y Z(填“大于”、“小于”或“等于”)。
(2)W可分别与X、Y形成多种化合物,其中,最简单化合物的稳定性由强到弱的顺序为
(用分子式表示);W、Y形成的化合物的种类比W、X形成的化合物的种类 (填“多”或“少”)。
(3)写出与XZ分子互为等电子体的一种离子的化学式 。
(4)向题给所得深蓝色溶液中再加乙醇,会析出深蓝色的[Q(NH3)4]SO4·H2O晶体,该晶体中含有的化学键有 ,[Q(NH3)4] 2+结构用示意图表示为 。
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:丁>丙>乙>丁
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
《齐民要术》中记载了二十三种利用谷物酿制食醋的工艺。其经历的三个主要发酵过程为:糖化→酒化→一醋化。下列说法不正确的是( )
A. 糖化过程是淀粉在微生物作用下分解成葡萄糖
B. 传统酿醋工艺均经历了酿酒的过程
C. 酒化和醋化都要在有氧环境中进行
D. 发酵液的温度控制到“小暖如人体”的程度是为了提高酶的活性
有关晶体的结构如下图所示,下列说法中不正确的是
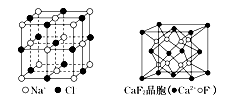

A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,6个碳原子形成一个环且不在同一平面上
D. 该气态团簇分子的分子式为EF或FE



