й«ҳдёӯ еҢ–еӯҰ
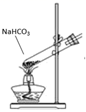 B . еҗёж”¶ж°Ёж°”
B . еҗёж”¶ж°Ёж°” 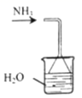 C . еҲ¶еҸ–SO2
C . еҲ¶еҸ–SO2 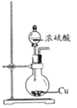 D . еҲҶзҰ»д№ҷй…ёд№ҷй…Ҝ
D . еҲҶзҰ»д№ҷй…ёд№ҷй…Ҝ 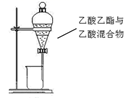
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү Ni2O3дёӯNiзҡ„еҢ–еҗҲд»·дёәпјҺ
-
пјҲ2пјү жҸҗй«ҳвҖңй…ёжөёвҖқгҖҒвҖңй…ёжә¶вҖқйҖҹзҺҮж—¶пјҢжё©еәҰдёҚе®ңиҝҮй«ҳпјҢе…¶еҺҹеӣ жҳҜпјҺ
-
пјҲ3пјү еҠ е…ҘH2O2вҖңж°§еҢ–вҖқзҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјӣж»ӨжёЈAзҡ„дё»иҰҒжҲҗеҲҶжҳҜпјҲеЎ«еҢ–еӯҰејҸпјүпјҺ
-
пјҲ4пјү е·ҘиүәдёӯеҲҶжӯҘеҠ е…ҘNa2CO3зҡ„дҪңз”ЁжҳҜпјӣдёәжҸҗй«ҳеҺҹж–ҷзҡ„еҲ©з”ЁзҺҮпјҢеә”жҺ§еҲ¶еҠ е…ҘNaClOдёҺNaOHзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәпјҺ
-
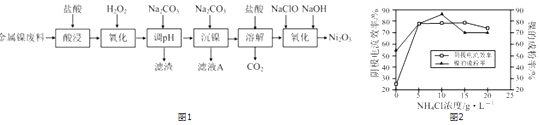
пјҲ5пјү е·ҘдёҡдёҠпјҢз”Ёй•ҚдёәйҳіжһҒпјҢз”өи§Ј0.1mol/L NiCl2жә¶ж¶ІдёҺдёҖе®ҡйҮҸNH4Clз»„жҲҗзҡ„ж··еҗҲжә¶ж¶ІпјҢеҸҜеҫ—й«ҳзәҜеәҰзҡ„зҗғеҪўи¶…з»Ҷй•ҚзІүпјҺеҪ“е…¶д»–жқЎд»¶дёҖе®ҡж—¶пјҢNH4Clзҡ„жө“еәҰеҜ№йҳҙжһҒз”өжөҒж•ҲзҺҮпјҲз”өжөҒж•ҲзҺҮжҳҜжҢҮз”өи§Јж—¶пјҢеңЁз”өжһҒдёҠе®һйҷ…жІүз§Ҝзҡ„зү©иҙЁзҡ„йҮҸдёҺзҗҶи®әжһҗеҮәйҮҸд№ӢжҜ”пјүеҸҠй•Қзҡ„жҲҗзІүзҺҮзҡ„еҪұе“ҚеҰӮеӣҫ2жүҖзӨәпјҡ
в‘ дёәиҺ·еҫ—й«ҳзәҜеәҰзҡ„зҗғеҪўи¶…з»Ҷй•ҚзІүпјҢNH4Clжә¶ж¶Ізҡ„жө“еәҰжңҖеҘҪжҺ§еҲ¶дёәmol/LпјҺ
в‘ЎеҪ“NH4Clжә¶ж¶Ізҡ„жө“еәҰеӨ§дәҺ15g/Lж—¶пјҢйҳҙжһҒжңүж°”дҪ“з”ҹжҲҗпјҢеҜјиҮҙйҳҙжһҒз”өжөҒж•ҲзҺҮйҷҚдҪҺпјҢиҜ·з»“еҗҲ平衡移еҠЁеҺҹзҗҶи§ЈйҮҠе…¶еҺҹеӣ пјҡпјҺ
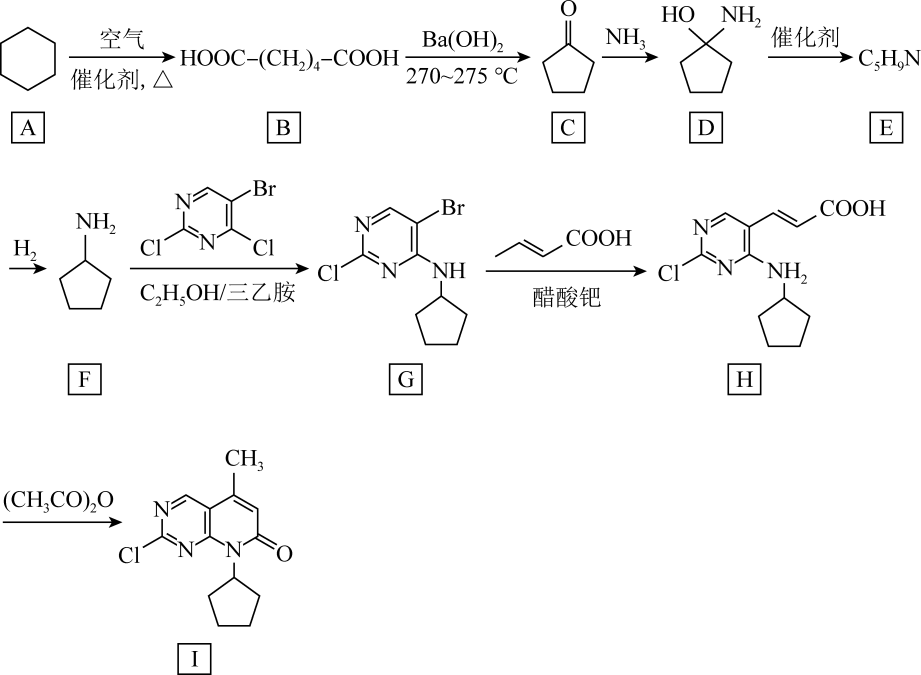
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү Aзҡ„еҗҚз§°дёәпјҢIзҡ„еҲҶеӯҗејҸдёәгҖӮ
-
пјҲ2пјү CвҶ’Dзҡ„еҸҚеә”зұ»еһӢдёәгҖҒGвҶ’Hзҡ„еҸҚеә”зұ»еһӢдёәгҖӮ
-
пјҲ3пјү еңЁдёҖе®ҡжқЎд»¶дёӢпјҢBдёҺе·ұдәҢиғәH2N(CH2)6NH2еҸ‘з”ҹзј©иҒҡеҸҚеә”з”ҹжҲҗеҗҲжҲҗзәӨз»ҙе°јйҫҷ-66пјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ4пјү FвҶ’GеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
-
пјҲ5пјү EеҲҶеӯҗдёӯеҗ«жңүзўізўіеҸҢй”®гҖӮеңЁEзҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯпјҢеҗҢж—¶еҗ«дә”е…ғзҺҜе’ҢзўізўіеҸҢй”®зҡ„еҗҢеҲҶејӮжһ„дҪ“е…ұжңүз§Қ(дёҚеҢ…еҗ«E)пјҢе…¶дёӯж ёзЈҒе…ұжҢҜж°ўи°ұдёӯеі°йқўз§ҜжҜ”дёә4пјҡ3пјҡ2зҡ„з»“жһ„з®ҖејҸжҳҜгҖӮ
-
пјҲ6пјү и®ҫи®Ўд»Ҙ
 е’ҢдёҷзғҜй…ё(CH2=CHCOOH)дёәиө·е§ӢеҺҹж–ҷпјҢеҗҲжҲҗ
е’ҢдёҷзғҜй…ё(CH2=CHCOOH)дёәиө·е§ӢеҺҹж–ҷпјҢеҗҲжҲҗ зҡ„и·Ҝзәҝ(е…¶е®ғиҜ•еүӮд»»йҖү)
зҡ„и·Ҝзәҝ(е…¶е®ғиҜ•еүӮд»»йҖү)
еңЁжұҪиҪҰе°ҫж°”еӨ„зҗҶиЈ…зҪ®дёӯеёёеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ4COпјӢ2NO2===4CO2пјӢN2гҖӮдёӢеҲ—еҜ№иҜҘеҸҚеә”зҡ„иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜ
A. иҜҘеҸҚеә”еұһдәҺзҪ®жҚўеҸҚеә”
B. иҜҘеҸҚеә”дёӯж°§еҢ–еүӮжҳҜCOпјҢиҝҳеҺҹеүӮжҳҜNO2
C. иҜҘеҸҚеә”з”ҹжҲҗ14 g N2ж—¶пјҢиҪ¬з§»4mol eпјҚ
D. иҜҘеҸҚеә”иғҪеҮҸе°‘жұҪиҪҰе°ҫж°”еҜ№зҺҜеўғзҡ„жұЎжҹ“
з”ЁNAиЎЁзӨәйҳҝдјҸеҫ·зҪ—еёёж•°пјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В (В В В В )
AпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4LH2Oеҗ«жңүзҡ„еҲҶеӯҗж•°дёә NA
BпјҺеёёжё©еёёеҺӢдёӢпјҢ1.06g Na2CO3еҗ«жңүзҡ„Na+зҰ»еӯҗж•°дёә0.02 NAВ В В В В В
CпјҺйҖҡеёёзҠ¶еҶөдёӢпјҢNA дёӘCO2еҲҶеӯҗеҚ жңүзҡ„дҪ“з§Ҝдёә22.4L
DпјҺзү©иҙЁзҡ„йҮҸжө“еәҰдёә0.5 mol/Lзҡ„MgCl2жә¶ж¶ІдёӯпјҢеҗ«жңүCl- дёӘж•°дёә NA
жңүдёҖ瓶жҫ„жё…зҡ„жә¶ж¶ІпјҢе…¶дёӯеҸҜиғҪеҗ«жңүNH4+гҖҒNa+гҖҒBa2+гҖҒAl3+гҖҒFe3пјӢгҖҒIпјҚгҖҒNO3-гҖҒCO32пјҚгҖҒSO42-гҖҒAlO2-пјҢ еҸ–иҜҘжә¶ж¶ІиҝӣиЎҢд»ҘдёӢе®һйӘҢпјҡ
(1) еҸ–PHиҜ•зәёжЈҖйӘҢпјҢжә¶ж¶Іе‘Ҳејәй…ёжҖ§пјҢеҸҜд»ҘжҺ’йҷӨВ В В В В В В В В В В В В В В зҰ»еӯҗзҡ„еӯҳеңЁгҖӮ
(2) еҸ–еҮәйғЁеҲҶжә¶ж¶ІпјҢеҠ е…Ҙе°‘йҮҸCCl4еҸҠж•°ж»ҙж–°еҲ¶ж°Ҝж°ҙпјҢз»ҸжҢҜиҚЎеҗҺCCl4еұӮе‘Ҳзҙ«зәўиүІпјҢеҸҜд»ҘжҺ’йҷӨВ В В В В В В В В В В зҰ»еӯҗзҡ„еӯҳеңЁгҖӮ
(3) еҶҷеҮә(2)жүҖеҸ‘з”ҹзҡ„еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
(4) еҸҰеҸ–еҮәйғЁеҲҶжә¶ж¶ІйҖҗжёҗеҠ е…ҘNaOHжә¶ж¶І,дҪҝжә¶ж¶Ід»Һй…ёжҖ§йҖҗжёҗеҸҳдёәзўұжҖ§пјҢеңЁж»ҙеҠ иҝҮзЁӢдёӯе’Ңж»ҙеҠ е®ҢжҜ•еҗҺпјҢжә¶ж¶ІеқҮж— жІүж·Җдә§з”ҹпјҢеҲҷеҸҲеҸҜд»ҘжҺ’йҷӨВ В В В В В В В В В В В В В зҰ»еӯҗзҡ„еӯҳеңЁгҖӮ[
(5) еҸ–еҮә(4)йғЁеҲҶдёҠиҝ°зўұжҖ§жә¶ж¶ІеҠ Na2CO3жә¶ж¶ІеҗҺ,жңүзҷҪиүІжІүж·Җз”ҹжҲҗпјҢиҜҒжҳҺВ В В В В зҰ»еӯҗеӯҳеңЁпјҢеҸҲеҸҜжҺ’йҷӨВ В В В _ зҰ»еӯҗзҡ„еӯҳеңЁгҖӮ
(6) е°Ҷ(4)еҫ—еҲ°зҡ„зўұжҖ§жә¶ж¶ІеҠ зғӯпјҢжңүж°”дҪ“ж”ҫеҮәпјҢиҜҘж°”дҪ“иғҪдҪҝж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қгҖӮ
ж №жҚ®дёҠиҝ°е®һйӘҢдәӢе®һзЎ®е®ҡпјҡиҜҘжә¶ж¶ІдёӯиӮҜе®ҡеӯҳеңЁзҡ„зҰ»еӯҗжҳҜВ В В В В В В В В В В В В В В В иӮҜе®ҡдёҚеӯҳеңЁзҡ„зҰ»еӯҗжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢиҝҳдёҚиғҪзЎ®е®ҡжҳҜеҗҰеӯҳеңЁзҡ„зҰ»еӯҗжҳҜВ В В В В В В пјҢйүҙеҲ«зҡ„ж–№жі•жҳҜВ В В В В В В В В В В В В (е…·дҪ“зҡ„ж“ҚдҪңж–№жі•)гҖӮ
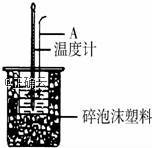 I.еҲ©з”ЁеҰӮеӣҫиЈ…зҪ®жөӢе®ҡдёӯе’Ңзғӯзҡ„е®һйӘҢжӯҘйӘӨеҰӮдёӢ
I.еҲ©з”ЁеҰӮеӣҫиЈ…зҪ®жөӢе®ҡдёӯе’Ңзғӯзҡ„е®һйӘҢжӯҘйӘӨеҰӮдёӢ
в‘ йҮҸеҸ–50mL 0.25mol/L H2SO4жә¶ж¶ІеҖ’е…Ҙе°Ҹзғ§жқҜдёӯпјҢжөӢйҮҸжё©еәҰпјӣ
в‘ЎйҮҸеҸ–50mL 0.55mol/L NaOHжә¶ж¶ІпјҢжөӢйҮҸжё©еәҰпјӣ
в‘ўе°ҶNaOHжә¶ж¶ІеҖ’е…Ҙе°Ҹзғ§жқҜдёӯпјҢж··еҗҲеқҮеҢҖеҗҺжөӢйҮҸж··еҗҲж¶Іжё©еәҰпјҺиҜ·еӣһзӯ”пјҡ
пјҲ1пјүеҰӮеӣҫжүҖзӨәпјҢд»ӘеҷЁAзҡ„еҗҚз§°жҳҜгҖҖВ В В В В В В В В В В В В В В В В В В гҖҖпјҺ
пјҲ2пјүNaOHжә¶ж¶ІзЁҚиҝҮйҮҸзҡ„еҺҹеӣ гҖҖВ В В В В В В В В В В В В В В В В В В В В В гҖҖпјҺ
пјҲ3пјүеҠ е…ҘNaOHжә¶ж¶Ізҡ„жӯЈзЎ®ж“ҚдҪңжҳҜгҖҖВ В В В В В В В В В гҖҖпјҲеЎ«еӯ—жҜҚпјүпјҺ
AпјҺжІҝзҺ»з’ғжЈ’зј“ж…ўеҠ е…ҘВ В BпјҺдёҖж¬Ўиҝ…йҖҹеҠ е…ҘВ В CпјҺеҲҶдёүж¬ЎеҠ е…Ҙ
пјҲ4пјүдёҠиҝ°е®һйӘҢжөӢеҫ—зҡ„з»“жһңдёҺд№ҰдёҠзҡ„57.3kJ/molжңүеҒҸе·®пјҢдә§з”ҹеҒҸе·®зҡ„еҺҹеӣ еҸҜиғҪжҳҜгҖҖВ В В В В В В В В В В гҖҖ
aпјҺе®һйӘҢиЈ…зҪ®дҝқжё©гҖҒйҡ”зғӯж•Ҳжһңе·®
bпјҺNaOHжә¶ж¶ІеҖ’е…ҘзӣӣжңүзЎ«й…ёзҡ„е°Ҹзғ§жқҜдёӯеҗҺжңӘеҸҠж—¶е°Ҷзӣ–жқҝзӣ–еҘҪпјҺ
cпјҺз”Ёжё©еәҰи®ЎжөӢе®ҡNaOHжә¶ж¶Іиө·е§Ӣжё©еәҰеҗҺзӣҙжҺҘжөӢе®ҡH2SO4жә¶ж¶Ізҡ„жё©еәҰ
пјҲ5пјүгҖҖВ В гҖҖпјҲеЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқпјүз”ЁBaпјҲOHпјү2д»Јжӣҝж°ўж°§еҢ–й’ жә¶ж¶Іе’ҢзЁҖзЎ«й…ёеҸҚеә”пјҢзҗҶз”ұжҳҜгҖҖВ В В В В В гҖҖпјҺ
пјҲ6пјүиӢҘе°Ҷеҗ«0.5mol H2SO4зҡ„жө“зЎ«й…ёдёҺеҗ«1mol NaOHзҡ„жә¶ж¶Іж··еҗҲпјҢж”ҫеҮәзҡ„зғӯйҮҸгҖҖВ В В В гҖҖпјҲеЎ«вҖңе°ҸдәҺвҖқгҖҒвҖңзӯүдәҺвҖқжҲ–вҖңеӨ§дәҺвҖқпјү57.3kJпјҢеҺҹеӣ жҳҜгҖҖВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖҖпјҺ
пјҲ7пјүе·ІзҹҘпјҡCH3COOHпјҲaqпјүдёҺNaOHпјҲaqпјүеҸҚеә”зҡ„в–іH=п№Ј12.1kJвҖўmolп№Ј1пјӣHClпјҲaqпјүдёҺNaOHпјҲaqпјүеҸҚеә”зҡ„в–іH=п№Ј55.6kJвҖўmolп№Ј1пјҺеҲҷCH3COOHеңЁж°ҙжә¶ж¶Ідёӯз”өзҰ»зҡ„в–іHзӯүдәҺгҖҖВ В В В В В В В В В В гҖҖпјҺ
AпјҺп№Ј67.7kJвҖўmolп№Ј1В В В BпјҺп№Ј43.5kJвҖўmolп№Ј1В CпјҺ+43.5kJвҖўmolп№Ј1В В DпјҺ+67.7kJвҖўmolп№Ј1пјҺ
IIпјҺжҹҗеҗҢеӯҰз”Ёдёӯе’Ңж»ҙе®ҡжі•жөӢе®ҡжҹҗзғ§зўұзҡ„зәҜеәҰпјҢе®һйӘҢиҝҮзЁӢеҰӮдёӢпјҡ
в‘ҙеҗ‘й”ҘеҪўз“¶дёӯеҠ е…ҘеҮ ж»ҙй…ҡй…һпјҢз”Ё0.2010molвҖўLп№Ј1ж ҮеҮҶзӣҗй…ёж»ҙе®ҡеҫ…жөӢзғ§зўұжә¶ж¶ІпјҢиҫ№ж»ҙиҫ№ж‘ҮеҠЁй”ҘеҪўз“¶пјҢзңјзқӣжіЁи§ҶгҖҖгҖҖгҖҖгҖҖВ В В В В В В В В гҖҖгҖҖпјҢзӣҙеҲ°гҖҖгҖҖгҖҖВ В В В В В В В В В В В В В В В В В В В В гҖҖгҖҖгҖҖж—¶еҒңжӯўж»ҙе®ҡпјҺ
в‘өдёӢеҲ—ж“ҚдҪңпјҢдјҡеҜјиҮҙе®һйӘҢз»“жһңеҒҸдҪҺзҡ„жҳҜгҖҖгҖҖгҖҖ гҖҖгҖҖгҖҖпјҲеЎ«еәҸеҸ·пјүпјӣиӢҘжҠҠеҫ…жөӢзғ§зўұжә¶ж¶Іж”ҫеңЁж»ҙе®ҡз®ЎдёӯпјҢеҲҷдјҡеҜјиҮҙе®һйӘҢз»“жһңеҒҸдҪҺзҡ„жҳҜгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖпјҺ
в‘ зўұејҸж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—еҮҖеҗҺжІЎжңүз”Ёеҫ…жөӢж¶Іж¶Ұжҙ—В в‘Ўз»ҲзӮ№иҜ»ж•°ж—¶дҝҜи§ҶпјҲж»ҙе®ҡеүҚиҜ»ж•°еҮҶзЎ®пјү
в‘ўй”ҘеҪўз“¶з”Ёи’ёйҰҸж°ҙжҙ—еҮҖеҗҺжІЎжңүз”Ёеҫ…жөӢж¶Іж¶Ұжҙ—В в‘Јй…ёејҸВ з®Ўе°–з«Ҝж°”жіЎжІЎжңүжҺ’йҷӨпјҢж»ҙе®ҡеҗҺж¶ҲеӨұ
в‘Өй…ёејҸж»ҙе®ҡз®Ўз”Ёи’ёйҰҸж°ҙжҙ—еҮҖеҗҺжІЎжңүз”Ёж ҮеҮҶж¶Іж¶Ұжҙ—В В в‘ҘжҢҜиҚЎж—¶й”ҘеҪўз“¶дёӯж¶Іж»ҙйЈһжә…еҮәжқҘпјҺ
еңЁ20 в„ғж—¶пјҢжҹҗж°”жҖҒзғғдёҺж°§ж°”ж··еҗҲпјҢиЈ…е…ҘеҜҶй—ӯе®№еҷЁдёӯпјҢзӮ№зҮғзҲҶзӮёеҗҺпјҢеҸҲжҒўеӨҚеҲ°20 в„ғпјҢжӯӨж—¶е®№еҷЁеҶ…ж°”дҪ“зҡ„еҺӢејәдёәеҸҚеә”еүҚзҡ„дёҖеҚҠпјҢз»ҸNaOHжә¶ж¶Іеҗёж”¶еҗҺпјҢе®№еҷЁеҶ…еҮ д№ҺжҲҗзңҹз©әпјҢжӯӨзғғзҡ„еҲҶеӯҗејҸеҸҜиғҪжҳҜ(гҖҖгҖҖ)
В В AпјҺC2H2 В В В В В В В В BпјҺC2H6 В В В В В В В В В В CпјҺC3H8 В В В В В В В В В В В В В В В DпјҺC7H16
жҹҗеӯҰж ЎеҢ–еӯҰеӯҰд№ е°Ҹз»„дёәжҺўз©¶дәҢж°§еҢ–ж°®зҡ„жҖ§иҙЁпјҢжҢүдёӢеӣҫжүҖзӨәиЈ…зҪ®иҝӣиЎҢе®һйӘҢгҖӮ
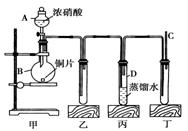
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
пјҲ1пјүиЈ…зҪ®з”Ідёӯзӣӣж”ҫжө“зЎқй…ёзҡ„д»ӘеҷЁAзҡ„еҗҚз§°жҳҜпјҡ________пјҢиҜҘиЈ…зҪ®дёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________________________________гҖӮ
пјҲ2пјүе®һйӘҢиҝҮзЁӢдёӯпјҢиЈ…зҪ®д№ҷгҖҒдёҷдёӯеҮәзҺ°зҡ„зҺ°иұЎеҲҶеҲ«жҳҜ________В В В В В В В В В ___пјӣ__________________В В иЈ…зҪ®дёҷдёӯзҡ„иҜ•з®ЎеҶ…еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_______В В В В В В В В В В В В В В В В В В В ______гҖӮ
пјҲ3пјүдёәдәҶжҺўз©¶NOзҡ„иҝҳеҺҹжҖ§пјҢеҸҜд»ҘеңЁиЈ…зҪ®дёҒзҡ„еҜјж°”з®ЎCдёӯйҖҡе…ҘдёҖз§Қж°”дҪ“пјӣйҖҡе…Ҙзҡ„иҝҷз§Қж°”дҪ“зҡ„еҗҚз§°жҳҜ________гҖӮ
е·ІзҹҘTВ°CгҖҒpkPaж—¶пјҢеңЁе®№з§ҜдёәvLзҡ„еҜҶй—ӯе®№еҷЁеҶ…е……жңү1molAе’Ң1molBгҖӮдҝқжҢҒжҒ’жё©гҖҒжҒ’еҺӢеҸҚеә”A(g)+B(g) ![]() В В C(g)иҫҫеҲ°е№іиЎЎж—¶пјҢCзҡ„дҪ“з§ҜеҲҶж•°дёә40%гҖӮиҜ•еӣһзӯ”жңүе…ій—®йўҳгҖӮ
В В C(g)иҫҫеҲ°е№іиЎЎж—¶пјҢCзҡ„дҪ“з§ҜеҲҶж•°дёә40%гҖӮиҜ•еӣһзӯ”жңүе…ій—®йўҳгҖӮ
пјҲ1пјүж¬ІдҪҝжё©еәҰе’ҢеҺӢејәеңЁдёҠиҝ°жқЎд»¶дёӢжҒ’е®ҡдёҚеҸҳпјҢеңЁеҜҶй—ӯе®№еҷЁеҶ…е……е…Ҙ2molA 2molB,еҲҷеҸҚеә”иҫҫеҲ°е№іиЎЎж—¶пјҢе®№еҷЁзҡ„е®№з§ҜдёәВ В В В В В В В В В В пјҢCзҡ„дҪ“з§ҜеҲҶж•°дёәВ В В В В В В В В В В гҖӮ
пјҲ2пјүиӢҘеҸҰйҖүдёҖе®№з§Ҝеӣәе®ҡдёҚеҸҳзҡ„еҜҶй—ӯе®№еҷЁпјҢд»ҚжҺ§еҲ¶жё©еәҰдёәTв„ғпјҢдҪҝ1molAе’Ң1molBеҸҚеә”иҫҫеҲ°е№іиЎЎзҠ¶жҖҒж—¶пјҢCзҡ„дҪ“з§ҜеҲҶж•°д»Қдёә40%пјҢеҲҷиҜҘеҜҶй—ӯе®№еҷЁзҡ„е®№з§ҜдёәВ В В В В В В В В В В гҖӮ
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸд№ҰеҶҷжӯЈзЎ®зҡ„жҳҜпјҲВ пјү
A.еҗ‘KIдёҺзЁҖзЎ«й…ёзҡ„ж··еҗҲжә¶ж¶ІдёӯйҖҡе…Ҙж°§ж°”пјҡ4H++O2+6IпјҚ![]() 3I2+2H2O
3I2+2H2O
B.дәҡзЎ«й…ёй’ жә¶ж¶ІдёҺеҸҢж°§ж°ҙж··еҗҲпјҡ![]() пјӢ2H2O2
пјӢ2H2O2![]()
![]() пјӢ2H2OпјӢO2вҶ‘
пјӢ2H2OпјӢO2вҶ‘
C.amolFeI2жә¶ж¶ІдёӯйҖҡе…Ҙ2a mol Cl2пјҡ2Fe2++4IпјҚ+3Cl2![]() 2I2+2Fe3++6ClпјҚ
2I2+2Fe3++6ClпјҚ
D.зЎ…й…ёй’ жә¶ж¶ІдёӯйҖҡе…ҘиҝҮйҮҸзҡ„CO2пјҡ![]() пјӢCO2пјӢH2O
пјӢCO2пјӢH2O![]() H2SiO3вҶ“пјӢ
H2SiO3вҶ“пјӢ![]()
жҹҗеҚ•е®ҳиғҪеӣўжңүжңәеҢ–еҗҲзү©пјҢеҸӘеҗ«зўігҖҒж°ўгҖҒж°§дёүз§Қе…ғзҙ пјҢзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдёә58пјҢе®Ңе…ЁзҮғзғ§ж—¶дә§з”ҹзӯүзү©иҙЁзҡ„йҮҸзҡ„CO2е’ҢH2OгҖӮе®ғеҸҜиғҪзҡ„з»“жһ„е…ұжңүпјҲдёҚиҖғиҷ‘з«ӢдҪ“ејӮжһ„пјү
В В A.4з§ҚВ В В В В В В В B.5з§ҚВ В В В В В В В C.6з§ҚВ В В В В В В В D.7з§Қ
еҗ‘еҗ«Fe2+гҖҒI-гҖҒBr-зҡ„жә¶ж¶ІдёӯйҖҡе…ҘиҝҮйҮҸзҡ„ж°Ҝж°”пјҢжә¶ж¶Ідёӯеӣӣз§ҚзІ’еӯҗзҡ„зү©иҙЁзҡ„йҮҸеҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҢе·ІзҹҘпјҡb-a=5пјҢзәҝж®өIVиЎЁзӨәдёҖз§Қеҗ«ж°§й…ёпјҢдё”Iе’ҢIVиЎЁзӨәзҡ„зү©иҙЁдёӯеҗ«жңүзӣёеҗҢзҡ„е…ғзҙ гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
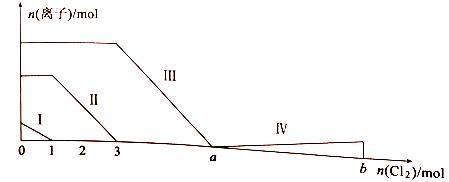
A.зәҝж®өIIВ иЎЁзӨәFe2+зҡ„еҸҳеҢ–жғ…еҶө
B.зәҝж®өIVеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡI2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C.ж №жҚ®еӣҫиұЎеҸҜи®Ўз®—a=6
D.еҺҹжә¶ж¶Ідёӯe(Fe2+):c(I-):c(Br-)=2:1:3
жұҪиҪҰеү§зғҲзў°ж’һж—¶пјҢе®үе…Ёж°”еӣҠдёӯеҸ‘з”ҹеҸҚеә”пјҡ10NaN3+2KNO3в•җK2O+5Na2O+16N2вҶ‘пјҢеҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ пјү
AпјҺKNO3жҳҜиҝҳеҺҹеүӮпјҢе…¶дёӯNе…ғзҙ иў«ж°§еҢ–
BпјҺз”ҹжҲҗзү©дёӯзҡ„N2жҳҜж°§еҢ–дә§зү©пјҢK2OжҳҜиҝҳеҺҹдә§зү©
CпјҺеҪ“ж°§еҢ–дә§зү©жҜ”иҝҳеҺҹдә§зү©еӨҡ2.8gж—¶пјҢиҪ¬з§»з”өеӯҗ1/14В mol
DпјҺж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”5пјҡ1
pHеҖјзӣёзӯүзҡ„зӣҗй…ёпјҲз”Іпјүе’ҢйҶӢй…ёпјҲд№ҷпјүпјҢзӣҗй…ёдёҺйҶӢй…ёжө“еәҰзҡ„еӨ§е°Ҹе…ізі»жҳҜпјҲВ пјү
A. з”Іпјқд№ҷВ В В B. з”Іпјңд№ҷВ В В C. з”Іпјһд№ҷВ В В D. дёҚзЎ®е®ҡ
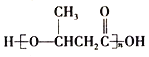 пјүзҡ„жөҒзЁӢеҰӮдёӢпјҡ
пјүзҡ„жөҒзЁӢеҰӮдёӢпјҡ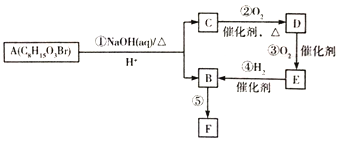
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳгҖӮ
пјҲ1пјүAзҡ„е®ҳиғҪеӣўеҗҚз§°жҳҜ_______пјӣCзҡ„зі»з»ҹе‘ҪеҗҚжҳҜ____________гҖӮ
пјҲ2пјүв‘ зҡ„еҸҚеә”зұ»еһӢжҳҜ_______пјҢв‘Өзҡ„еҸҚеә”зұ»еһӢжҳҜ___________гҖӮ
пјҲ3пјүеҶҷеҮәеҸҚеә”в‘ўзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ______________________гҖӮ
пјҲ4пјүж»Ўи¶ідёӢеҲ—жқЎд»¶зҡ„BеҗҢеҲҶејӮжһ„дҪ“жңү____з§ҚгҖӮ
в… .иғҪдёҺNaеҸҚеә”дә§з”ҹж°”дҪ“ в…Ў.иғҪдёҺNaOH еҸҚеә” в…ў.дёҚиғҪдёҺNa2CO3еҸҚеә”гҖӮ
иӢҘдёҺNaOHжә¶ж¶ІеҸҚеә”зҡ„жңүжңәзү©дёӯзҡ„зўіеҺҹеӯҗж•°зӣ®дёә2пјҢеҲҷе…¶з»“жһ„з®ҖејҸжҳҜ__________гҖӮ
пјҲ5пјүе·ІзҹҘпјҡ
в… .
в…Ў.

еҶҷеҮәд»ҘCH2=CHCH=CH2дёәеҺҹж–ҷеҲ¶еӨҮCзҡ„еҗҲжҲҗи·ҜзәҝжөҒзЁӢеӣҫпјҲж— жңәиҜ•еүӮеҸҜд»Ҙд»»йҖүпјүпјҡ__________гҖӮ



