й«ҳдёӯ еҢ–еӯҰ
-
пјҲ1пјү пјҲIпјүе°ҶдёҖе®ҡиҙЁйҮҸNa2CO3е’ҢNaHCO3зҡ„еқҮеҢҖж··еҗҲзү©еҲҶжҲҗзӯүйҮҸзҡ„дёӨд»ҪгҖӮе°Ҷе…¶дёӯзҡ„дёҖд»ҪзӣҙжҺҘеҠ зғӯиҮіжҒ’йҮҚпјҢиҙЁйҮҸеҮҸиҪ»дәҶ1.24gпјӣеҸҰдёҖд»ҪеҠ е…ҘдёҖе®ҡйҮҸжҹҗжө“еәҰзҡ„зӣҗй…ёиҮіжҒ°еҘҪеҸҚеә”е®Ңе…ЁпјҢ收йӣҶеҲ°ж ҮеҮҶзҠ¶еҶөдёӢ2.24Lж°”дҪ“пјҢж¶ҲиҖ—зӣҗй…ё80.0mLгҖӮ
еҺҹеқҮеҢҖж··еҗҲзү©дёӯNaHCO3зҡ„зү©иҙЁзҡ„йҮҸпјҡn(NaHCO3)=
-
пјҲ2пјү зӣҗй…ёзҡ„жө“еәҰc(HClпјү=
-
пјҲ3пјү (II)е°Ҷ2.80gеҗ«ж°§еҢ–й•Ғзҡ„й•ҒжқЎе®Ңе…Ёжә¶дәҺ50.0mLзЎ«й…ёжә¶ж¶ІеҗҺпјҢж»ҙеҠ 2.00mo1/Lж°ўж°§еҢ–й’ ж¶ІпјҢжҒ°еҘҪе®Ңе…ЁжІүж·Җж—¶з”ЁеҺ»200.0mLгҖӮе°ҶжүҖеҫ—жІүж·ҖзҒјзғ§гҖҒеҶ·еҚҙеҗҺз§°йҮҸеҫ—еӣәдҪ“иҙЁйҮҸдёә4.40gгҖӮ
дёҠиҝ°зЎ«й…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰc(H2SO4)пјқ
-
пјҲ4пјү й•ҒжқЎдёӯж°§еҢ–й•Ғе’Ңй•Ғзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәn(MgO)пё°n(Mg)пјқ
 вҖӢ
вҖӢ
 еҸҜд»ҘеҲҶеҲ«з”ЁзҪ®жҚўжі•гҖҒзӣҙжҺҘеҠ зғӯжі•е’Ңз”өи§Јжі•еҶ¶зӮјеҫ—еҲ°
B . еҗ‘з…®жІёзҡ„
еҸҜд»ҘеҲҶеҲ«з”ЁзҪ®жҚўжі•гҖҒзӣҙжҺҘеҠ зғӯжі•е’Ңз”өи§Јжі•еҶ¶зӮјеҫ—еҲ°
B . еҗ‘з…®жІёзҡ„  жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙе°‘йҮҸйҘұе’Ң
жә¶ж¶ІдёӯйҖҗж»ҙеҠ е…Ҙе°‘йҮҸйҘұе’Ң  жә¶ж¶ІпјҢеҸҜеҲ¶еҫ—
жә¶ж¶ІпјҢеҸҜеҲ¶еҫ— 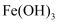 иғ¶дҪ“
C . й…ёжҖ§ж°§еҢ–зү©дёҖе®ҡжҳҜйқһйҮ‘еұһж°§еҢ–зү©пјҢж··еҗҲзү©гҖҒеҲҶж•Јзі»гҖҒиғ¶дҪ“жңүд»Һеұһе…ізі»
D .
иғ¶дҪ“
C . й…ёжҖ§ж°§еҢ–зү©дёҖе®ҡжҳҜйқһйҮ‘еұһж°§еҢ–зү©пјҢж··еҗҲзү©гҖҒеҲҶж•Јзі»гҖҒиғ¶дҪ“жңүд»Һеұһе…ізі»
D .  еҸҜдёҺ
еҸҜдёҺ  еҸҚеә”з”ҹжҲҗ
еҸҚеә”з”ҹжҲҗ  е’Ңж°ҙпјҢж•…
е’Ңж°ҙпјҢж•…  еұһдәҺй…ёжҖ§ж°§еҢ–зү©
еұһдәҺй…ёжҖ§ж°§еҢ–зү©
-
пјҲ1пјү еҶҷеҮәCзҡ„з»“жһ„з®ҖејҸгҖӮ
-
пјҲ2пјү еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„еҸҚеә”зұ»еһӢпјҡ в‘ пјҢв‘ЈгҖӮ
-
пјҲ3пјү еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ
в‘ЎгҖӮ
в‘ӨгҖӮ
-
пјҲ1пјү CгҖҒOгҖҒSiдёүз§Қе…ғзҙ з”өиҙҹжҖ§з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјӣ第дёҖз”өзҰ»иғҪI1пјҲSiпјүI1пјҲGeпјүпјҲеЎ«вҖң>вҖқжҲ–вҖң<вҖқпјүгҖӮ
-
пјҲ2пјү еҹәжҖҒGeеҺҹеӯҗд»·з”өеӯҗжҺ’еёғејҸдёәпјӣSiO2гҖҒGeO2е…·жңүзұ»дјјзҡ„жҷ¶дҪ“з»“жһ„пјҢSiO2зҶ”зӮ№иҫғй«ҳпјҢе…¶еҺҹеӣ жҳҜ
-
пјҲ3пјү еҰӮеӣҫдёәзЎјй…ёжҷ¶дҪ“зҡ„зүҮеұӮз»“жһ„пјҢе…¶дёӯзЎјеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёәгҖӮиҜҘжҷ¶дҪ“дёӯеӯҳеңЁзҡ„дҪңз”ЁеҠӣжңүгҖӮ
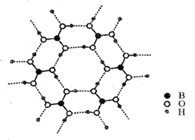
AпјҺе…ұд»·й”® BпјҺзҰ»еӯҗй”® CпјҺж°ўй”®
-
пјҲ4пјү Feе’ҢCuеҸҜеҲҶеҲ«дёҺж°§е…ғзҙ еҪўжҲҗдҪҺд»·жҖҒж°§еҢ–зү©FeOе’ҢCu2OгҖӮ
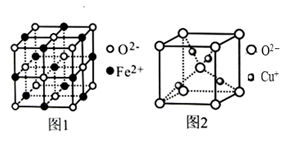
в‘ FeOз«Ӣж–№жҷ¶иғһз»“жһ„еҰӮеӣҫ1жүҖзӨәпјҢеҲҷFe2пјӢзҡ„й…ҚдҪҚж•°дёәгҖӮ
в‘ЎCu2Oз«Ӣж–№жҷ¶иғһз»“жһ„еҰӮеӣҫ2жүҖзӨәпјҢиӢҘжҷ¶иғһиҫ№й•ҝдёәacmпјҢеҲҷиҜҘжҷ¶дҪ“зҡ„еҜҶеәҰдёәgВ·cmпјҚ3гҖӮпјҲз”Ёеҗ«aгҖҒNAзҡ„д»Јж•°ејҸиЎЁзӨәпјҢNAд»ЈиЎЁйҳҝдјҸеҠ еҫ·зҪ—еёёж•°пјү
 H2вҶ‘+Cl2вҶ‘+2OHп№Ј
B . ж°ҜеҢ–й“Ғжә¶ж¶Іи…җиҡҖй“ңжқҝпјҡFe3++Cu=Fe2++Cu2+
C . ж°ўж°§еҢ–й’ жә¶ж¶Іеҗёж”¶е°‘йҮҸдәҢж°§еҢ–зЎ«SO2+OHп№Ј=HSO3п№Ј
D . зЁҖзЎ«й…ёдёӯеҠ ж°ўж°§еҢ–й’Ўжә¶ж¶ІиҮідёӯжҖ§пјҡBa2++H++OHп№Ј+SO42п№Ј=BaSO4вҶ“+H2O
H2вҶ‘+Cl2вҶ‘+2OHп№Ј
B . ж°ҜеҢ–й“Ғжә¶ж¶Іи…җиҡҖй“ңжқҝпјҡFe3++Cu=Fe2++Cu2+
C . ж°ўж°§еҢ–й’ жә¶ж¶Іеҗёж”¶е°‘йҮҸдәҢж°§еҢ–зЎ«SO2+OHп№Ј=HSO3п№Ј
D . зЁҖзЎ«й…ёдёӯеҠ ж°ўж°§еҢ–й’Ўжә¶ж¶ІиҮідёӯжҖ§пјҡBa2++H++OHп№Ј+SO42п№Ј=BaSO4вҶ“+H2O
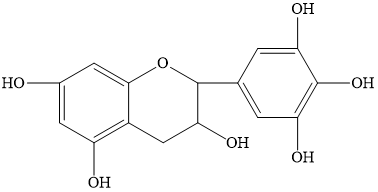
в‘ еҲҶеӯҗејҸдёәC15H14O7
в‘Ў1molе„ҝиҢ¶зҙ AдёҺи¶ійҮҸзҡ„жө“жәҙж°ҙеҸҚеә”пјҢжңҖеӨҡж¶ҲиҖ—Br2 4mol
в‘ў1molе„ҝиҢ¶зҙ AеңЁдёҖе®ҡжқЎд»¶дёӢжңҖеӨҡиғҪдёҺ6mol H2еҠ жҲҗ
в‘ЈзӯүиҙЁйҮҸзҡ„е„ҝиҢ¶зҙ AеҲҶеҲ«дёҺи¶ійҮҸзҡ„йҮ‘еұһй’ е’Ңж°ўж°§еҢ–й’ еҸҚеә”ж¶ҲиҖ—йҮ‘еұһй’ е’Ңж°ўж°§еҢ–й’ зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1пјҡ1
зЎ«й…ёй’ҷжҳҜдёҖз§Қз”ЁйҖ”йқһеёёе№ҝжіӣзҡ„дә§е“ҒпјҢеҸҜз”ЁдәҺз”ҹдә§зЎ«й…ёгҖҒжјӮзҷҪзІүзӯүдёҖзі»еҲ—зү©иҙЁпјҲи§ҒдёӢеӣҫпјүгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
В В В В В В 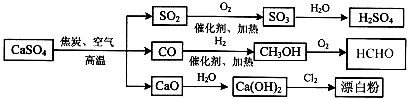
AпјҺCOгҖҒSO2гҖҒSO3еқҮжҳҜй…ёжҖ§ж°§еҢ–зү©
BпјҺе·ҘдёҡдёҠеҲ©з”ЁCl2е’Ңжҫ„жё…зҹізҒ°ж°ҙеҸҚеә”жқҘеҲ¶еҸ–жјӮзҷҪзІү
CпјҺйҷӨеҺ»дёҺж°ҙеҸҚеә”пјҢеӣҫзӨәиҪ¬еҢ–еҸҚеә”еқҮдёәж°§еҢ–иҝҳеҺҹеҸҚеә”
DпјҺз”ЁCOеҗҲжҲҗCH3OHиҝӣиҖҢеҗҲжҲҗHCHOзҡ„дёӨжӯҘеҸҚеә”пјҢеҺҹеӯҗеҲ©з”ЁзҺҮеқҮдёә100%
дёӢеҲ—е®һйӘҢи®ҫи®ЎиғҪеӨҹжҲҗеҠҹзҡ„жҳҜ(гҖҖгҖҖ)
| йҖүйЎ№ | е®һйӘҢзӣ®зҡ„ | е®һйӘҢжӯҘйӘӨеҸҠзҺ°иұЎ |
| A | жЈҖйӘҢдәҡзЎ«й…ёй’ иҜ•ж ·жҳҜеҗҰеҸҳиҙЁ | иҜ•ж · |
| B | жЈҖйӘҢжҹҗзӣҗжҳҜеҗҰдёәй“өзӣҗ | иҜ•ж · |
| C | иҜҒжҳҺй…ёжҖ§жқЎд»¶дёӢH2O2ж°§еҢ–жҖ§жҜ”I2ејә | NaIжә¶ж¶І |
| D | йҷӨеҺ»ж°ҜеҢ–й’ жҷ¶дҪ“дёӯе°‘йҮҸзЎқй…ёй’ҫ | иҜ•ж ·
|
дёӢеҲ—йҖ’еҸҳжғ…еҶөдёӯдёҚжӯЈзЎ®зҡ„жҳҜ
AпјҺHFгҖҒHClгҖҒHBrгҖҒHIзҡ„жІёзӮ№дҫқж¬ЎеҚҮй«ҳ
BпјҺзЎ…гҖҒзЈ·гҖҒзЎ«гҖҒж°Ҝе…ғзҙ зҡ„жңҖй«ҳжӯЈеҢ–еҗҲд»·дҫқж¬ЎеҚҮй«ҳ
CпјҺO2-гҖҒF-гҖҒNa+гҖҒMg2+зҡ„зҰ»еӯҗеҚҠеҫ„дҫқж¬ЎеўһеӨ§
DпјҺй”ӮгҖҒй’ гҖҒй’ҫгҖҒй“·зҡ„йҮ‘еұһжҖ§дҫқж¬Ўеўһејә
еҰӮеӣҫжҳҜе…ғзҙ е‘ЁжңҹиЎЁдёӯзҹӯе‘Ёжңҹзҡ„дёҖ![]() йғЁеҲҶпјҢеӣӣз§Қе…ғзҙ дёӯеҸӘжңүдёҖз§ҚжҳҜйҮ‘еұһпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
йғЁеҲҶпјҢеӣӣз§Қе…ғзҙ дёӯеҸӘжңүдёҖз§ҚжҳҜйҮ‘еұһпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
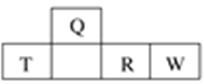
A. ж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§пјҡW>R
B. е…ғзҙ Tзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©еҸҜиғҪжҳҜејәзўұ
C. Qзҡ„еҺҹеӯҗеҚҠеҫ„жҜ”Tе°Ҹ
D. Wе’ҢQзҡ„еҺҹеӯҗеәҸж•°зӣёе·®10
еңЁжңүжңәзү©пјҡв‘ CH3CH3гҖҒв‘ЎCH2пјқCH2гҖҒв‘ўCH3CH2CвүЎCHгҖҒ
в‘ЈCH3CвүЎCCH3гҖҒв‘ӨC2H6гҖҒ в‘ҘCH3CHпјқCH2дёӯпјҢдёҖе®ҡдә’дёәеҗҢзі»зү©зҡ„жҳҜВ В В В В В В В В В В В В В пјҢдёҖе®ҡдә’дёәеҗҢеҲҶејӮжһ„дҪ“зҡ„жҳҜВ В В В В В В В В В В В В В В гҖӮпјҲеЎ«зј–еҸ·пјү
(1)в‘ е°Ҷеәҹй’’еӮ¬еҢ–еүӮ(дё»иҰҒжҲҗеҲҶV2O5)дёҺзЁҖзЎ«й…ёгҖҒдәҡзЎ«й…ёй’ҫжә¶ж¶Іж··еҗҲпјҢе……еҲҶеҸҚеә”пјҢжүҖеҫ—жә¶ж¶Іжҳҫй…ёжҖ§пјҢеҗ«VO2пјӢгҖҒKпјӢгҖҒSO![]() зӯүгҖӮеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
зӯүгҖӮеҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
в‘Ўеҗ‘дёҠиҝ°жүҖеҫ—жә¶ж¶ІдёӯеҠ е…ҘKClO3жә¶ж¶ІпјҢе……еҲҶеҸҚеә”еҗҺпјҢжә¶ж¶Ідёӯж–°еўһеҠ дәҶVO![]() гҖҒClпјҚгҖӮеҶҷеҮә并й…Қе№іиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҢ并ж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж•°зӣ®е’Ңж–№еҗ‘В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
гҖҒClпјҚгҖӮеҶҷеҮә并й…Қе№іиҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҢ并ж ҮеҮәз”өеӯҗиҪ¬з§»зҡ„ж•°зӣ®е’Ңж–№еҗ‘В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
(2)е°Ҷй…ёжҖ§жқЎд»¶дёӢпјҢй“ҒдёҺNO![]() еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸиЎҘе……е®Ңж•ҙпјҡ
еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸиЎҘе……е®Ңж•ҙпјҡ
![]() FeпјӢ
FeпјӢ![]() NO
NO![]() пјӢ
пјӢ![]() В В В В В В В ===
В В В В В В В ===![]() Fe2пјӢпјӢ
Fe2пјӢпјӢ![]() NH
NH![]() пјӢ
пјӢ![]() В В В В В В В
В В В В В В В
(3)е…ӯ价铬[Cr(в…Ҙ)]жңүеү§жҜ’пјҢеәҹж°ҙдёӯзҡ„Cr2O![]() еёёз”Ёй“Ғж°§зЈҒдҪ“жі•йҷӨеҺ»пјҢеҚіжҠҠиҝҮйҮҸзҡ„FeSO4В·7H2OеҠ е…Ҙеҗ«Cr2O
еёёз”Ёй“Ғж°§зЈҒдҪ“жі•йҷӨеҺ»пјҢеҚіжҠҠиҝҮйҮҸзҡ„FeSO4В·7H2OеҠ е…Ҙеҗ«Cr2O![]() зҡ„еәҹж°ҙдёӯпјҢи°ғиҠӮpH<4пјҢFe2пјӢе°ҶCr(в…Ҙ)иҝҳеҺҹдёәCr3пјӢгҖӮ
зҡ„еәҹж°ҙдёӯпјҢи°ғиҠӮpH<4пјҢFe2пјӢе°ҶCr(в…Ҙ)иҝҳеҺҹдёәCr3пјӢгҖӮ
еҶҷеҮәдёҠиҝ°Fe2пјӢиҝҳеҺҹCr2O![]() зҡ„зҰ»еӯҗж–№зЁӢејҸпјҢ并ж ҮжҳҺз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
зҡ„зҰ»еӯҗж–№зЁӢејҸпјҢ并ж ҮжҳҺз”өеӯҗиҪ¬з§»зҡ„ж–№еҗ‘е’Ңж•°зӣ®пјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
е®һйӘҢе®ӨеҲ¶еӨҮж°Ёж°”пјҢжЈҖйӘҢжҳҜеҗҰ收йӣҶж»Ўзҡ„жӯЈзЎ®ж–№жі•жҳҜВ В В В В В В В В В В В В пјҲВ В В пјү
AгҖҒз”ЁжүӢжүҮеҠЁж”¶йӣҶзҡ„ж°”дҪ“пјҢжңүж°”е‘іеҲҷ已收йӣҶж»Ў
BгҖҒе°Ҷж¶Ұж№ҝзҡ„ж·ҖзІү-KIиҜ•зәёжҺҘиҝ‘瓶еҸЈпјҢиҜ•зәёеҸҳи“қеҲҷ已收йӣҶж»Ў
CгҖҒе°Ҷж¶Ұж№ҝзҡ„зәўиүІзҹіи•ҠиҜ•зәёдјёе…Ҙ瓶еҶ…пјҢиҜ•зәёеҸҳи“қеҲҷ已收йӣҶж»Ў
DгҖҒз”ЁзҺ»з’ғжЈ’дёҖз«ҜиҳёеҸ–жө“зӣҗй…ёпјҢжҺҘиҝ‘瓶еҸЈпјҢдә§з”ҹеӨ§йҮҸзҷҪзғҹпјҢиҜҒжҳҺ已收йӣҶж»Ў
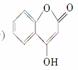 жҳҜдёҖз§ҚеҢ»иҚҜдёӯй—ҙдҪ“пјҢеёёз”ЁжқҘеҲ¶еӨҮжҠ—еҮқиЎҖиҚҜпјҢеҸҜйҖҡиҝҮдёӢеҲ—и·ҜзәҝеҗҲжҲҗпјҡ
жҳҜдёҖз§ҚеҢ»иҚҜдёӯй—ҙдҪ“пјҢеёёз”ЁжқҘеҲ¶еӨҮжҠ—еҮқиЎҖиҚҜпјҢеҸҜйҖҡиҝҮдёӢеҲ—и·ҜзәҝеҗҲжҲҗпјҡ
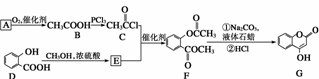
(1)AдёҺ银氨жә¶ж¶ІеҸҚеә”жңү银й•ңз”ҹжҲҗпјҢеҲҷAзҡ„з»“жһ„з®ҖејҸжҳҜ
________________________________________________________________________гҖӮ
(2)BвҶ’Cзҡ„еҸҚеә”зұ»еһӢжҳҜ______________гҖӮ
(3)Eзҡ„з»“жһ„з®ҖејҸжҳҜ
________________________________________________________________________гҖӮ
(4)еҶҷеҮәFе’ҢиҝҮйҮҸNaOHжә¶ж¶Іе…ұзғӯж—¶еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ
________________________________________________________________________
_______________________________________________________________________гҖӮ
(5)дёӢеҲ—е…ідәҺGзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ________гҖӮ
aпјҺиғҪдёҺжәҙеҚ•иҙЁеҸҚеә”
bпјҺиғҪдёҺйҮ‘еұһй’ еҸҚеә”
cпјҺ1 mol GжңҖеӨҡиғҪе’Ң3 molж°ўж°”еҸҚеә”
dпјҺеҲҶеӯҗејҸжҳҜC9H6O3
иғҪжәҗеҸҜеҲҶдёәдёҖзә§иғҪжәҗе’ҢдәҢзә§иғҪжәҗпјҢиҮӘ然з•Ңдёӯд»ҘзҺ°жҲҗеҪўејҸжҸҗдҫӣзҡ„иғҪжәҗз§°дёәдёҖзә§иғҪжәҗпјҢйңҖдҫқ
йқ е…¶д»–иғҪжәҗй—ҙжҺҘеҲ¶еҸ–зҡ„иғҪжәҗдёәдәҢзә§иғҪжәҗгҖӮжҜ”еҰӮж°ўж°”е°ұжҳҜдёҖз§Қй«ҳж•ҲиҖҢжІЎжңүжұЎжҹ“зҡ„дәҢзә§иғҪжәҗгҖӮжҚ®жӯӨеҲӨж–ӯпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ
AпјҺз…ӨжҳҜдёҖзә§иғҪжәҗВ В В В В В В В В В В В В В В В В В В B.зҹіжІ№жҳҜдәҢзә§иғҪжәҗ
В В В CпјҺз„ҰзӮүжіЁжӮҰжҳҜдёҖзә§иғҪжәҗВ В В В В В В В В В В В В DпјҺеӨ©з„¶ж°”жҳҜдәҢзә§иғҪжәҗ
AгҖҒBгҖҒCгҖҒDжҳҜеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§зҡ„еӣӣз§Қзҹӯе‘Ёжңҹе…ғзҙ пјҢз”ІгҖҒд№ҷгҖҒдёҷгҖҒдёҒгҖҒжҲҠжҳҜз”ұе…¶дёӯзҡ„дёӨз§ҚжҲ–дёүз§Қе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©пјҢиҖҢиҫӣжҳҜз”ұCе…ғзҙ еҪўжҲҗзҡ„еҚ•иҙЁпјҺе·ІзҹҘпјҡз”І+д№ҷ=дёҒ+иҫӣпјҢз”І+дёҷ=жҲҠ+иҫӣпјӣеёёжё©дёӢ0.1mol/LдёҒжә¶ж¶Ізҡ„pHдёә13пјҢеҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
AпјҺе…ғзҙ CеҪўжҲҗзҡ„еҚ•иҙЁеҸҜд»ҘеңЁзӮ№зҮғжқЎд»¶еҲҶеҲ«дёҺе…ғзҙ AгҖҒBгҖҒDеҪўжҲҗзҡ„еҚ•иҙЁеҢ–еҗҲпјҢжүҖеҫ—еҢ–еҗҲзү©еқҮеӯҳеңЁе…ұд»·й”®
BпјҺе…ғзҙ BгҖҒCгҖҒDзҡ„еҺҹеӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјҡrпјҲDпјүпјһrпјҲCпјүпјһrпјҲBпјү
CпјҺ1.0 L 0.1 mol/LжҲҠжә¶ж¶Ідёӯеҗ«йҳҙзҰ»еӯҗжҖ»зҡ„зү©иҙЁзҡ„йҮҸе°ҸдәҺ0.1 mol
DпјҺ1 molз”ІдёҺи¶ійҮҸзҡ„д№ҷе®Ңе…ЁеҸҚеә”е…ұиҪ¬з§»зәҰ1.204Г—1024дёӘз”өеӯҗ



