云南省玉溪市第一中学2020-2021年高一上学期第二次月考化学免费试卷带答案和解析
| 1. 选择题 | 详细信息 |
|
中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是:( ) A.《本草纲目》中记载“(火药)乃焰消( B.《本草经集注》中记载了区分硝石( C.《神农本草经》中提到:“白青(Cu2(OH)2CO3)得铁化为铜”,其中白青属于碱 D.侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
|
| 2. 选择题 | 详细信息 |
|
化学与生产、生活密切相关。下列说法错误的是 A.活性炭可用于净水 B.碳酸钠可用作糕点膨松剂 C.过氧化钠可用作呼吸面具供氧剂 D.氧化钙可用作食品干燥剂 |
|
| 3. 选择题 | 详细信息 |
|
2020年5月,北京大学教授研究团队在碳基芯片的研发方面实现重大突破,碳基芯片就是以碳基材料制作的碳纳米晶体管芯片,被业内视为目前硅基芯片的最佳替代品之一,成为中国打破美国半导体技术封锁的关键之一。下列说法正确的是( ) A.碳基芯片是胶体,能发生丁达尔效应。 B.胶体和溶液都是混合物 C.胶体经短时间静置后会沉淀 D.用滤纸可以分离胶体和溶液 |
|
| 4. 选择题 | 详细信息 |
|
下列关于钠及其化合物的叙述正确的( ) A.金属钠是银白色金属,硬度很大 B.将Na投入盐酸中,先与水反应,生成的NaOH再和HCl反应 C.等质量的NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多 D.鉴别Na2CO3和NaHCO3溶液,可用CaCl2,不可用Ca(OH)2 |
|
| 5. 选择题 | 详细信息 |
|
需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是 A.称量  B.溶解 B.溶解 C.转移 C.转移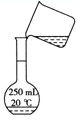 D.定容 D.定容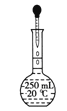 |
|
| 6. 选择题 | 详细信息 | |
如图是某矿泉水的部分标签说明:
则该饮用水中还可能较大量存在的离子是( ) |
||
| 7. 选择题 | 详细信息 |
|
某溶液中含有HCO A.NO C.Na+、NO |
|
| 8. 选择题 | 详细信息 | ||||||||||||||||||||
利用如图装置可以完成的实验组合是( )
|
|||||||||||||||||||||
| 9. 选择题 | 详细信息 |
|
下列溶液中Cl-浓度最大的是( ) A.100mL3mol/LMgCl2溶液 B.1000mL4mol/LNaCl溶液 C.300mL7mol/LNaClO溶液 D.250mL1.5mol/LAlCl3溶液 |
|
| 10. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法不正确的是( ) A.22.4L(标准状况)氩气含有的质子数为18NA B.1molK2Cr2O7被还原为Cr3+转移的电子数为6NA C.标准状况下,28g N2和CO的混合气体所含原子数为2NA D.1.8gNH |
|
| 11. 选择题 | 详细信息 |
|
NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA B.常温常压下,32gO2和O3的混合气体中含有的原子数为2NA C.标准状况下,22.4LH2O所含的氧原子数目为NA D.标准状况下,将22.4LCl2通入足量水中充分反应,转移电子数为NA |
|
| 12. 选择题 | 详细信息 |
为测定气球内的气体成分,某同学用超薄的气球按如图装置进行实验。开始时气球沉于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯口。气球内盛放的气体可能是( ) A.O2 B.H2 C.NH3 D.SO2 |
|
| 13. 选择题 | 详细信息 | ||||||||||||||||||||
下列除去物质中少量杂质的方法错误的是( )
A.A B.B C.C D.D |
|||||||||||||||||||||
| 14. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A.KHCO3溶液与足量Ca(OH)2溶液反应:HCO B.氢氧化镁与稀盐酸反应:OH-+H+=H2O C.向Fe2(SO4)3溶液中滴入Ba(OH)2溶液:Fe3++3OH-=Fe(OH)3↓ D.钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
|
| 15. 选择题 | 详细信息 |
|
下列有关Na2O和Na2O2的叙述正确的是( ) A.都能和水反应生成碱,都是碱性氧化物 B.向与水反应后的溶液中滴加酚酞,都是先变红后褪色 C.都能和H2O、CO2发生氧化还原反应 D.在空气中长期放置,最终都变为Na2CO3 |
|
| 16. 选择题 | 详细信息 |
|
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的产物并不改变的是( ) A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.Na2CO3和盐酸 |
|
| 17. 选择题 | 详细信息 |
|
自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真伪的是( ) A. 酚酞溶液 B. 氯化钡溶液 C. 氢氧化钠溶液 D. 硝酸银溶液 |
|
| 18. 选择题 | 详细信息 |
|
某溶液中含有较大量的Cl-、 ①滴加足量的Mg(NO3)2溶液;②过滤;③滴加适量的AgNO3溶液;④滴加足量的Ba(NO3)2溶液 A.①②④②③ B.④②①②③ C.①②③②④ D.④②③②① |
|
| 19. 选择题 | 详细信息 |
|
在标准状况下,由CO和CO2组成的混合气体13.44 L,质量为20 g。此混合气体中C和O两种原子的物质的量之比为 A.3∶4 B.4∶3 C.2∶1 D.1∶2 |
|
| 20. 选择题 | 详细信息 |
|
把aL含硫酸铵、硝酸铵的溶液分成两等份,一份用bmol烧碱刚好把NH4+转化为NH3,另一份与氯化钡溶液完全反应消耗cmolBaCl2.则原溶液中NO3-的浓度为( ) A. |
|
| 21. 选择题 | 详细信息 |
|
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 A.21:5 B.11:3 C.5:1 D.3:1 |
|
| 22. 计算题 | 详细信息 |
|
物质的量是高中化学常用的物理量,请完成以下有关计算: |
|
| 23. | 详细信息 |
A~H为中学化学中常见物质,其转化关系如图所示,其中“O”代表化合物,“口”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体,F为金属单质。请回答下列问题: (1)G的化学式为___________,G中阴、阳离子个数比为___________,每生成1 mol E转移电子的物质的量为___________。 (2)A、D的水溶液均呈___________(填“酸性”“碱性”或“中性”)。反应①②③④中属于氧化还原反应的有___________个。A~H中焰色呈黄色的物质有___________种。 (3)写出下列反应的化学方程式。 A→B+C+D:___________,G+C:___________。 |
|
| 24. 实验题 | 详细信息 | ||||||||||||||||||||
|
某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知: ①A中反应为KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O; ②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。  (1)A反应中氧化产物和还原产物的质量比为________。 (2)写出B装置中反应的离子方程式_________。实验结束后,立即将B中溶液滴几滴在蓝色石蕊试纸上,可观察到的现象是________。 (3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III 处依次放入的物质正确的是___________(填编号)。
(4)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其有效成份为___________(填化学式)。 |
|||||||||||||||||||||
| 25. 实验题 | 详细信息 |
|
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题: (1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),本实验所需玻璃仪器E规格为___________mL。 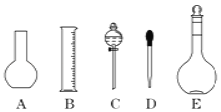 (2)下列操作中,容量瓶所不具备的功能有___________(填序号)。 A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液 C.用来加热溶解固体 D.量取一定体积的液体 (3)根据计算用托盘天平称取NaOH的质量为___________g。在实验中其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度___________0.1mol/L (填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度___________0.1mol/L。 (4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为___________mL(计算结果保留一位小数)。如果实验室有10mL、25mL、50mL量筒,应选用___________mL规格的量筒最好。 |
|
| 26. 计算题 | 详细信息 |
取一定物质的量浓度的NaOH溶液100 mL,向其通入一定量的CO2气体,得到溶质为Na2CO3和NaHCO3的溶液A,向A中逐滴缓慢加入2mol·L-1的盐酸,产生CO2的体积与所加盐酸的体积之间关系如图所示。(假设产生的 CO2全部逸出) (1)加入盐酸0~50mL时发生的离子方程式为__________。 (2)Na2CO3与NaHCO3的物质的量之比是___________。 (3)通入的CO2的物质的量为___________。 (4)原NaOH溶液的物质的量浓度是___________。 |
|
最近更新




