е…«жүҖдёӯеӯҰеңЁзәҝеҒҡйўҳ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ёжө“зЎ«й…ёй…ҚеҲ¶зЁҖзЎ«й…ёж—¶пјҢдёҚеҝ…иҰҒзҡ„дёӘдәәе®үе…ЁйҳІжҠӨз”Ёе“ҒжҳҜ A. е®һйӘҢжңҚ B. ж©Ўиғ¶жүӢеҘ— C. жҠӨзӣ®й•ң D. йҳІжҜ’йқўзҪ© |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯиЎЁзӨәжӯЈзЎ®зҡ„жҳҜ A.ж°ҹзҰ»еӯҗзҡ„з»“жһ„зӨәж„Ҹеӣҫпјҡ B.з”Іиғә(ж°Ёеҹәз”Ізғ·)зҡ„з»“жһ„з®ҖејҸпјҡCH3вҖ”NH2 C.жәҙеҢ–й“өзҡ„з”өеӯҗејҸпјҡ 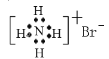 D.дёӯеӯҗж•°дёә177пјҢиҙЁеӯҗж•°дёә116зҡ„LvеҺҹеӯҗпјҡ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺзҺҜеўғгҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—дёҺеҢ–еӯҰжңүе…ізҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A.иҠӮж—ҘзҮғж”ҫзғҹиҠұгҖҒзҲҶз«№еҜ№зҺҜеўғзҡ„жұЎжҹ“еҸҜеҝҪз•Ҙ B.вҖңй…ёйӣЁвҖқжҳҜз”ұеӨ§ж°”дёӯзҡ„зўігҖҒж°®гҖҒзЎ«зҡ„ж°§еҢ–зү©жә¶дәҺйӣЁж°ҙйҖ жҲҗзҡ„ C.йӣҫйңҫжҳҜдёҖз§ҚеҲҶж•Јзі»пјҢеёҰжҙ»жҖ§зӮӯеҸЈзҪ©еҸҜеҮҸе°‘йӣҫйңҫеҜ№дәәдҪ“зҡ„дјӨе®і D.家еәӯз”Ёзҡ„вҖң84вҖқж¶ҲжҜ’ж¶ІдёҺжҙҒеҺ•зҒөж··еҗҲеҗҺж¶ҲжҜ’иғҪеҠӣжҲ–жё…жҙҒиғҪеҠӣеҠ ејә |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗж–№зЁӢејҸзҡ„д№ҰеҶҷжӯЈзЎ®зҡ„жҳҜ A.еҗ‘Al2(SO4)3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸж°Ёж°ҙпјҡAl3++3NH3вҲҷH2O=Al(OH)3вҶ“+3 B.й“ҒзІүдёҺзЁҖзЎ«й…ёеҸҚеә”пјҡ2Fe+6H+=2Fe3++3H2вҶ‘ C.ж°ўж°§еҢ–й’Ўжә¶ж¶ІдёҺзЁҖзЎ«й…ёеҸҚеә”пјҡBa2++ D.еңЁж°ҜеҢ–дәҡй“Ғжә¶ж¶ІдёӯйҖҡе…Ҙж°Ҝж°”пјҡCl2+Fe2+=Fe3++2Cl- |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜ A.FeOеҸҜз”ЁдҪңйЈҹе“ҒйҷӨж°§еүӮ B.жҳҺзҹҫеҸҜйҷӨеҺ»ж°ҙдёӯзҡ„жӮ¬жө®зү© C.зҹіиӢұз ӮеҸҜдҪңи®Ўз®—жңәзӯүз”өеӯҗи®ҫеӨҮзҡ„иҠҜзүҮ D.д№ҷзғҜеҸҜеӮ¬зҶҹжһңе®һ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
3-з”ІеҹәжҲҠзғ·зҡ„дёҖж°Ҝд»Јдә§зү©жңүпјҲдёҚиҖғиҷ‘з«ӢдҪ“ејӮжһ„пјү A.3з§Қ B.4з§Қ C.5з§Қ D.6з§Қ |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁжҖ§иҙЁзҡ„жҜ”иҫғпјҢз»“и®әжӯЈзЎ®зҡ„жҳҜ A.еҲҶеӯҗзҡ„жһҒжҖ§пјҡ C.зү©иҙЁзҡ„жІёзӮ№пјҡ |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е®һйӘҢи®ҫи®ЎжӯЈзЎ®зҡ„жҳҜ A.е°ҶSO2йҖҡе…Ҙжәҙж°ҙдёӯжқҘжЈҖйӘҢSO2зҡ„иҝҳеҺҹжҖ§ B.д»ҘеҚ•иҙЁй“ҒдҪңдёәйҳіжһҒпјҢеҚ•иҙЁй”°дҪңдёәйҳҙжһҒпјҢзЁҖH2SO4дҪңдёәз”өи§ЈиҙЁжә¶ж¶Із»„жҲҗз”өи§Јжұ жқҘйӘҢиҜҒй“Ғзҡ„жҙ»жіјжҖ§ејәдәҺй”° C.е°ҶNaOHзЁҖжә¶ж¶Іж»ҙе…Ҙжҹҗжә¶ж¶ІпјҢеҠ зғӯжә¶ж¶ІеҗҺз”Ёж№ҝж¶Ұзҡ„зәўиүІзҹіи•ҠиҜ•зәёжЈҖжөӢз”ҹжҲҗзҡ„ж°”дҪ“пјҢд»ҘжӯӨжқҘйӘҢиҜҒе…¶дёӯжҳҜеҗҰеӯҳеңЁ D.е°ҶCl2йҖҡе…ҘиЈ…жңүж№ҝж¶Ұзҡ„зәўиүІе“ҒзәўиҜ•зәёзҡ„иҜ•еүӮ瓶дёӯпјҢжЈҖйӘҢCl2зҡ„жјӮзҷҪжҖ§ |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Іж¶ІдёӯпјҢеҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰиЎЁиҝ°жӯЈзЎ®зҡ„жҳҜ A.0.1molВ·L-1зҡ„(NH4)2SO4жә¶ж¶Ідёӯпјҡc( B.0.1molВ·L-1зҡ„NaHCO3жә¶ж¶Ідёӯпјҡc(NaпјӢ)=c( C.0.1molВ·L-1ж°Ёж°ҙдёӯпјҡc(OH-)=c( D.еңЁ25в„ғ100mLNH4Clжә¶ж¶Ідёӯпјҡc(Cl-)=c( |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘеҸҚеә”CO(g)+H2O(g)вҮҢCO2(g)+H2(g) О”Hпјң0пјҢеңЁдёҖе®ҡжё©еәҰе’ҢеҺӢејәдёӢдәҺеҜҶй—ӯе®№еҷЁдёӯпјҢеҸҚеә”иҫҫеҲ°е№іиЎЎгҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A.еҚҮй«ҳжё©еәҰпјҢKеҮҸе°Ҹ B.еҮҸе°ҸеҺӢејәпјҢn(CO2)еўһеҠ C.жӣҙжҚўй«ҳж•ҲеӮ¬еҢ–еүӮпјҢОұ(CO)еўһеӨ§ D.е……е…ҘдёҖе®ҡйҮҸзҡ„ж°®ж°”пјҢn(H2)ж”№еҸҳ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еҗҲзү©дёӯпјҢж—ўиғҪеҸ‘з”ҹеҸ–д»ЈеҸҚеә”еҸҲиғҪеҸ‘з”ҹеҠ жҲҗеҸҚеә”зҡ„жңү( ) A. CH3-CH=CH2 B. CH3CH2CH2OH C. 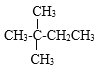 D. D. |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
дёҖз§Қй«ҳиғҪзәізұізә§Fe3S4е’Ңй•Ғзҡ„дәҢж¬Ўз”өжұ зҡ„е·ҘдҪңеҺҹзҗҶдёәпјҡFe3S4+4Mg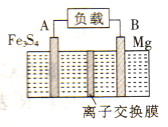 A.ж”ҫз”өж—¶пјҢй•Ғз”өжһҒдёәиҙҹжһҒ B.иҜҘдәҢж¬Ўз”өжұ дёҚиғҪд»Ҙејәй…ёжҖ§жә¶ж¶ІдҪңдёәз”өи§ЈиҙЁжә¶ж¶І C.е……з”өж—¶пјҢйҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәMgS+2e-=Mg+S2- D.еӣҫдёӯжүҖзӨәзҰ»еӯҗдәӨжҚўиҶңеә”дҪҝз”ЁйҳізҰ»еӯҗдәӨжҚўиҶң |
|
| 13. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEдә”з§Қдё»ж—Ҹе…ғзҙ еҲҶеұһдёүдёӘзҹӯе‘ЁжңҹпјҢдё”еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮBгҖҒDзҡ„еҺҹеӯҗеәҸж•°д№Ӣе·®дёә8пјҢBеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶ж¬ЎеӨ–еұӮз”өеӯҗж•°зҡ„3еҖҚпјҢCеҺҹеӯҗеңЁеҗҢе‘Ёжңҹдё»ж—Ҹе…ғзҙ дёӯеҺҹеӯҗеҚҠеҫ„жңҖеӨ§гҖӮ еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүBеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®дёә пјӣ Aзҡ„еҚ•иҙЁдёҺEзҡ„еҚ•иҙЁеҸҚеә”зҡ„жқЎд»¶жҳҜ гҖӮ пјҲ2пјүBгҖҒCгҖҒDеҺҹеӯҗзҡ„еҚҠеҫ„д»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ пјҲз”Ёе…ғзҙ з¬ҰеҸ·иЎЁзӨәпјүпјӣ CеҚ•иҙЁдёҺAзҡ„ж°§еҢ–зү©еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ гҖӮ пјҲ3пјүи®ҫи®Ўе®һйӘҢиҜҒжҳҺEзҡ„йқһйҮ‘еұһжҖ§жҜ”Dзҡ„йқһйҮ‘еұһжҖ§ејә пјҲеҶҷеҮәж“ҚдҪңжӯҘйӘӨеҸҠзҺ°иұЎпјүгҖӮ пјҲ4пјүAзҡ„еҚ•иҙЁе’ҢBзҡ„еҚ•иҙЁиғҪз»„жҲҗз”өжұ пјҢеҪ“з”өи§ЈиҙЁжә¶ж¶ІдёәDзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©зҡ„зЁҖжә¶ж¶Іж—¶пјҢиҙҹжһҒдёҠзҡ„з”өжһҒеҸҚеә”ејҸдёә гҖӮ |
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ІзҹҘпјҡеҸҚеә”Fe(s)+CO2(g)вҮҢFeO(s)+CO(g) в–іH>0пјҢе№іиЎЎеёёж•°дёәKгҖӮ (1)дёҖе®ҡжё©еәҰдёӢпјҢеҗ‘1LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҠ е…Ҙи¶ійҮҸй“ҒзІү并充е…Ҙl.5molCO2ж°”дҪ“еҸ‘з”ҹеҸҚеә”пјҡFe(s)+CO2(g)вҮҢFeO(s)+CO(g)пјҢCO2зҡ„жө“еәҰдёҺж—¶й—ҙзҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҡ 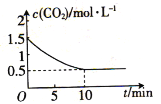 в‘ иҜҘеҸҚеә”е№іиЎЎеҗҺc(CO)=_______mo1вҲҷL-1пјӣиҜҘжқЎд»¶дёӢеҸҚеә”зҡ„е№іиЎЎеёёж•°K=_______гҖӮ в‘ЎдёӢеҲ—жҺӘж–ҪдёӯиғҪдҪҝе№іиЎЎйҖҶеҗ‘移еҠЁзҡ„жҳҜ_______(еЎ«еӯ—жҜҚ)гҖӮ A.йҷҚдҪҺжё©еәҰ B.еҮҸе°ҸеҺӢејә C.еҶҚе……е…ҘдёҖе®ҡйҮҸCO2 D.еҶҚеҠ е…ҘдёҖе®ҡйҮҸй“ҒзІү (2)еҸҜйҖҶеҸҚеә”Fe(s)+CO2(g)вҮҢFeO(s)+CO(g)зҡ„йҖҶеҸҚеә”йҖҹзҺҮйҡҸж—¶й—ҙеҸҳеҢ–зҡ„е…ізі»еҰӮеӣҫгҖӮ  д»ҺеӣҫдёӯзңӢеҲ°пјҢеҸҚеә”еңЁt2.ж—¶иҫҫеҲ°е№іиЎЎпјҢеңЁt1ж—¶ж”№еҸҳдәҶжҹҗз§ҚжқЎд»¶пјҢеҲҷж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪжҳҜ_______(еЎ«еӯ—жҜҚ)гҖӮ A.еҚҮжё© B.еўһеӨ§COжө“еәҰ C.дҪҝз”ЁеӮ¬еҢ–еүӮ (3)еҗ‘еҗ«жңүBaSO4еӣәдҪ“зҡ„жә¶ж¶Ідёӯж»ҙеҠ Na2CO3жә¶ж¶ІпјҢеҪ“жңүBaCO3жІүж·Җз”ҹжҲҗж—¶жә¶ж¶Ідёӯ |
|
| 15. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зўұејҸж¬Ўж°Ҝй…ёй•Ғ[BMHпјҢеҢ–еӯҰејҸдёәMg2ClO(OH)3В·H2O]жҳҜдёҖз§ҚзҷҪиүІзІүжң«пјҢйҡҫжә¶дәҺж°ҙпјҢд№ҹжҳҜж–°дёҖд»Јж— жңәжҠ—иҸҢеүӮгҖӮеҸҜд»ҘCl2гҖҒNaOHеҸҠMgCl2дёәеҺҹж–ҷеҲ¶еҸ–гҖӮ (1)з”Із»„еҗҢеӯҰжӢҹеҲ©з”ЁдёӢеҲ—иЈ…зҪ®еҲ¶еӨҮиҙЁйҮҸеҲҶж•°зәҰдёә5пј…зҡ„ж¬Ўж°Ҝй…ёй’ жә¶ж¶ІгҖӮ 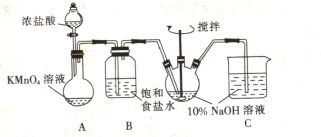 в‘ зӣӣKMnO4жә¶ж¶Ізҡ„д»ӘеҷЁеҗҚз§°дёә_______гҖӮ в‘ЎBиЈ…зҪ®дёӯйҘұе’ҢйЈҹзӣҗж°ҙзҡ„дҪңз”Ёдёә_______гҖӮ в‘ўе·ІзҹҘCl2е’ҢNaOHеңЁиҫғй«ҳзҡ„жё©еәҰдёӢеҸҚеә”дјҡз”ҹжҲҗNaClO3пјҢеӣ жӯӨжҺ§еҲ¶еҸҚеә”еңЁ0пҪһ5в„ғиҢғеӣҙеҶ…иҝӣиЎҢпјҢе®һйӘҢдёӯйҖӮе®ңзҡ„жҺӘж–ҪжҳҜ_______гҖӮ (2)д№ҷз»„еҗҢеӯҰжӢҹеҲ©з”Ёз”Із»„еҗҢеӯҰеҲ¶еҫ—зҡ„еҗ«NaClOзҡ„жә¶ж¶ІеҲ¶еҸ–зўұејҸж¬Ўж°Ҝй…ёй•ҒпјҢжӯҘйӘӨеҰӮдёӢпјҡ 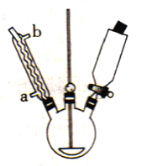 жӯҘйӘӨlпјҡеҫҖзғ§з“¶дёӯеҠ е…Ҙж°ҜеҢ–й•ҒпјҢејҖеҠЁжҗ…жӢҢеҷЁе№¶еҚҮжё©еҲ°80в„ғпјӣ жӯҘйӘӨ2пјҡйҖҗж»ҙж»ҙе…ҘNaClOзҡ„жә¶ж¶Іпјӣ жӯҘйӘӨ3пјҡи°ғиҠӮжә¶ж¶ІpH=10пјҢеӣһжөҒеҸҚеә”4hпјӣ жӯҘйӘӨ4пјҡиҝҮж»ӨпјҢзғҳе№ІгҖӮ в‘ еӣҫдёӯеӣһжөҒж—¶пјҢж°ҙд»ҺжҺҘеҸЈ_______(еЎ«вҖңaвҖқжҲ–вҖңbвҖқ)иҝӣе…ҘгҖӮ в‘ЎиҝҮж»Өж—¶пјҢйңҖз”ЁеҲ°зҡ„зҺ»з’ғд»ӘеҷЁйҷӨзғ§жқҜеӨ–пјҢиҝҳйңҖ_______гҖӮ в‘ўеҶҷеҮәMgCl2гҖҒNaOHгҖҒCl2еҸҚеә”еҲ¶еҸ–Mg2ClO(OH)3В·H2Oзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ_______ |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жқҗж–ҷзҡ„ејҖеҸ‘гҖҒеә”з”Ёе’ҢеҸ‘еұ•жҳҜ科жҠҖиҝӣжӯҘзҡ„з»“жһңпјҢеҗҢж—¶пјҢжқҗж–ҷзҡ„еҸ‘еұ•д№ҹдҝғиҝӣдәҶ科жҠҖзҡ„иҝӣжӯҘе’ҢеҸ‘еұ•гҖӮ (1)й«ҳзәҜеәҰз ·еҸҜз”ЁдәҺз”ҹдә§ж–°еһӢеҚҠеҜјдҪ“жқҗж–ҷGaAsпјҢз ·зҡ„з”өеӯҗжҺ’еёғејҸдёә_______гҖӮ (2)еҜ№зЎқеҹәиӢҜй…ҡж°ҙеҗҲзү©жҳҜдёҖз§Қе…·жңүзү№ж®ҠеҠҹиғҪзҡ„зү©иҙЁпјҢе…¶з»“жһ„з®ҖејҸдёә зү©иҙЁдёӯеҮ з§Қе…ғзҙ зҡ„第дёҖз”өзҰ»иғҪз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜ_______гҖӮ (3)ж°®еҢ–зЎј(BN)жҷ¶дҪ“жҳҜдёҖз§Қж–°еһӢж— жңәеҗҲжҲҗжқҗж–ҷгҖӮBNжҷ¶дҪ“жңүОұгҖҒОІдёӨз§Қзұ»еһӢпјҢдё”ОұвҖ”BNз»“жһ„дёҺзҹіеўЁзӣёдјјпјҢОІвҖ”BNз»“жһ„дёҺйҮ‘еҲҡзҹізӣёдјјгҖӮ в‘ ОұвҖ”BNжҷ¶дҪ“дёӯNеҺҹеӯҗжқӮеҢ–ж–№ејҸжҳҜ_______гҖӮ в‘ЎОІвҖ”BNжҷ¶дҪ“дёӯпјҢжҜҸдёӘзЎјеҺҹеӯҗеҪўжҲҗ_______дёӘе…ұд»·й”®пјҢиҝҷдәӣе…ұд»·й”®дёӯпјҢжңү_______дёӘй…ҚдҪҚй”®гҖӮ (4)в‘ еӮЁж°ўжқҗж–ҷзҡ„з ”з©¶жҳҜеҸ‘еұ•ж°ўиғҪжәҗзҡ„жҠҖжңҜйҡҫзӮ№д№ӢдёҖгҖҒжҹҗзү©иҙЁзҡ„еҲҶеӯҗеҸҜд»ҘйҖҡиҝҮж°ўй”®еҪўжҲҗвҖңз¬јзҠ¶з»“жһ„вҖқпјҢеӣ жӯӨеҸҜжҲҗдёәжҪңеңЁеӮЁж°ўжқҗж–ҷпјҢеҲҷиҜҘеҲҶеӯҗдёҖе®ҡдёҚеҸҜиғҪжҳҜ_______гҖӮ A.H2O B.CH4 C.HF D.CO(NH2)2 в‘ЎNiе’ҢLaзҡ„еҗҲйҮ‘жҳҜзӣ®еүҚдҪҝз”Ёе№ҝжіӣзҡ„еӮЁж°ўжқҗж–ҷпјҢе…·жңүе®№йҮҸеӨ§гҖҒеҜҝе‘Ҫй«ҳгҖҒиҖҗдҪҺжё©зӯүзү№зӮ№пјҢеңЁж—Ҙжң¬е’ҢдёӯеӣҪе·Іе®һзҺ°дә§дёҡеҢ–пјҢиҜҘеҗҲйҮ‘зҡ„жҷ¶иғһеҰӮеӣҫжүҖзӨәгҖӮе·ІзҹҘиҜҘеҗҲйҮ‘зҡ„ж‘©е°”иҙЁйҮҸдёәMgВ·mol-1пјҢеҜҶеәҰдёәdgВ·cm3еҲҷиҜҘжҷ¶иғһзҡ„дҪ“з§Ҝдёә_______cm3(з”Ёеҗ«dгҖҒMгҖҒNAзҡ„д»Јж•°ејҸиЎЁзӨәпјҢи®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖј)гҖӮ 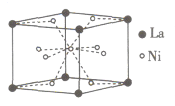 |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- ж”ёеҺҝ第дёүдёӯеӯҰйҷ„зӯ”жЎҲдёҺи§Јжһҗ
- 2018е№ҙиҮі2019е№ҙй«ҳдәҢдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲеұұиҘҝзңҒе№ійҒҘдёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёүдёҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲдёҠжө·еёӮеҗҢжөҺеӨ§еӯҰ第дёҖйҷ„еұһдёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдәҢ第дәҢж¬Ўйҳ¶ж®өжЈҖжөӢеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеұұдёңзңҒдёңиҗҘеёӮе№ҝйҘ¶еҺҝ第дёҖдёӯеӯҰпјү
- е№ҝдёңзңҒе№ҝе·һеёӮи¶Ҡз§ҖеҢә2020-2021е№ҙй«ҳдәҢдёҠеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№иҜ•еҚ·еңЁзәҝжЈҖжөӢ
- дёҠжө·дәӨйҖҡеӨ§еӯҰйҷ„еұһдёӯеӯҰй«ҳдәҢеҢ–еӯҰ2018е№ҙдёҠеӯҰжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ
- еӣӣе·қзңҒз»өйҳіеёӮеҚ—еұұдёӯеӯҰ2021еұҠй«ҳдёүдёӢжңҹејҖеӯҰиҖғиҜ•зҗҶ科综еҗҲеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- 2019е№ҙе№ҝдёңзңҒе№ҝе·һеёӮй«ҳдёү第дёҖж¬Ўи°ғз ”жөӢиҜ•еҢ–еӯҰиҖғйўҳ
жңҖиҝ‘жӣҙж–°



