亳州市在线免费考试
| 1. 选择题 | 详细信息 |
|
下列物质的保存方法不正确的是 A.漂白粉可以露置于空气中 B.金属钠保存在煤油中 C.过氧化钠应密封保存 D.新制氯水应保存在棕色试剂瓶中,并放置于阴凉处 |
|
| 2. 选择题 | 详细信息 |
|
下列实验现象的描述错误的是( ) A.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 B.红热的铜丝在氯气中剧烈燃烧,发出棕黄色的烟 C.过氧化钠可在呼吸面具中做供氧剂 D.氢气在氯气中燃烧生成苍白色烟雾 |
|
| 3. 选择题 | 详细信息 |
|
下列反应中不属于氧化还原反应的是 A. Br2+2KI═I2+2KBr B. NH3+HCl═NH4Cl C. NO+NO2+2NaOH═2NaNO2+H2O D. 2H2O2═2H2O+O2↑ |
|
| 4. 选择题 | 详细信息 |
|
某无色酸性溶液中一定能大量共存的离子组是( ) A.Na+、 Ba2+、Cl-、 C.Cl-、 Fe3+、K+、 Na+ D.Na+、 K+、 |
|
| 5. 选择题 | 详细信息 |
|
下列离子方程式中,错误的是( ) A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ B.氯化钡溶液与硫酸反应:Ba2++ C.钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ D.氢氧化铜与稀硫酸反应:Cu(OH)2+2H+=Cu2++2H2O |
|
| 6. 选择题 | 详细信息 |
向一定体积的Ba(OH)2溶液中逐滴加入H2SO4溶液,测得混合溶液的导电能力随时间的变化曲线如下图所示。下列说法正确的是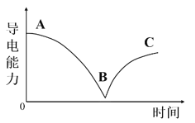 A.AB段溶液的导电能力不断减弱,说明产物BaSO4是非电解质 B.AB段反应的离子方程式为:Ba2++OH-+H++ C.BC段溶液的导电能力不断增强,说明过量的Ba(OH)2发生电离 D.BC段溶液中:Al3+、Na+、 |
|
| 7. 选择题 | 详细信息 |
|
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( ) A.2NaX+Z2=2NaZ+X2 B.2NaW+Z2=2NaZ+W2 C.2NaW+Y2=2NaY+W2 D.2NaZ+X2=2NaX+Z2 |
|
| 8. 选择题 | 详细信息 |
|
对于反应:2H2S+SO2=3S↓+2H2O,则该反应中被氧化和被还原的S原子数之比为( ) A.1:1 B.1:2 C.2:1 D.3:1 |
|
| 9. 选择题 | 详细信息 | ||||||||||||||||||||||||||||||
下列物质的分类正确的是( )
|
|||||||||||||||||||||||||||||||
| 10. 选择题 | 详细信息 |
|
下列关于钠及其化合物的叙述正确的是( ) ①Na2O与Na2O2都能和水反应生成碱,它们都是化合反应 ②Na2O与Na2O2的阴阳离子个数比都是1:2 ③钠在常温下不容易被氧化 ④向酚酞溶液中加入Na2O2粉末,溶液先变红后褪色,并有气泡生成 A.②④ B.①②④ C.②③ D.只有④ |
|
| 11. 选择题 | 详细信息 |
|
下列叙述中正确的是 A.某溶液中加入硝酸银溶液产生白色沉淀,该溶液中一定含氯离子 B.某溶液中加入稀盐酸有气泡产生,该溶液中一定含碳酸根离子 C.某溶液中加入氯化钡溶液后产生白色沉淀,再加稀硝酸沉淀不溶解。该溶液中一定含硫酸根离子 D.某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀溶解,溶液中可能含Ba2+或Ca2+ |
|
| 12. 选择题 | 详细信息 |
|
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时看到火焰呈黄色,下列判断正确的是( ) A.只含Na+ B.既含有Na+,又含有K+ C.一定含Na+,可能含有K+ D.可能含有Na+,可能还含有K+ |
|
| 13. 选择题 | 详细信息 |
|
将金属钠投入盛有下列溶液的小烧杯中,既有气体生成,又有白色沉淀产生的是(不考虑反应中溶液温度的变化)( ) ① A.①④ B.②③ C.①②④ D.④⑤ |
|
| 14. 选择题 | 详细信息 |
|
已知有如下反应:①2 A.Cl2在①反应中作还原剂 B.Cl2在反应②中既是氧化产物又是还原产物 C.氧化性强弱的顺序为: D.溶液中可发生: |
|
| 15. 选择题 | 详细信息 |
下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中湿润的红色布条褪色;当关闭B时,C处湿润的红色布条颜色无变化。则D瓶中盛有的溶液可以是( ) A.浓硫酸 B.浓氢氧化钠溶液 C.硫酸钠溶液 D.饱和氯化钠溶液 |
|
| 16. 选择题 | 详细信息 |
|
过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( ) A.Na2CO3和Na2O2 B.只有Na2CO3 C.Na2CO3和NaOH D.Na2O和NaHCO3 |
|
| 17. 选择题 | 详细信息 |
某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( ) A.该实验说明Cl2分子具有漂白性 B.该实验说明H+扩散速度比HClO分子快 C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色 D.若用久置的氯水进行实验,现象相同 |
|
| 18. 选择题 | 详细信息 |
|
己知在碱性溶液中可发生如下反应: 2R(OH)3+ 3C1O-+ 4OH-= 2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( ) A. +3 B. +4 C. +5 D. +6 |
|
| 19. 填空题 | 详细信息 |
|
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。 I.甲同学向氯化铁溶液中加入少量的NaOH溶液; II.乙同学向沸水中滴加饱和氯化铁溶液后,长时间加热; III.丙同学向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。 (1)其中操作正确的同学是___________;他的操作中涉及到的制备胶体的离子反应方程式为____________________________________________________________。 (2)判断胶体制备是否成功,可利用胶体的____________________。 (3)丁同学将所制得的Fe(OH)3胶体分成两份,并进行下列实验: ①将其中一份装入U形管内,用石墨作电极,接通直流电,通电一段时 间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带______(填“正”或“负”)电荷。 ②向另一份Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。 a.先出现红褐色沉淀,原因是___________________________________________________________; b.随后沉淀溶解,此反应的离子方程式是________________________________________________。 |
|
| 20. 填空题 | 详细信息 |
|
有以下8种物质,请回答下列问题: ①干冰 ②氯化钠 ③蔗糖 ④稀硫酸 ⑤NaHSO4 溶液 ⑥碳酸氢钠 ⑦氢氧化钡溶液 ⑧NH3 (1)其中能导电的是_____________(填写符号,下同);属于电解质的是______________;属于非电解质的是______________。 (2)写出物质⑤在水中的电离方程式:________________________________________________________。 (3)写出物质④和⑦反应的离子方程式:______________________________________________________。 (4)写出少量物质⑥和过量的物质⑦发生反应的离子方程式:____________________________________。 |
|
| 21. 填空题 | 详细信息 |
|
已知反应: ①SO3+ H2O=H2SO4 ②3NO2+H2O=2HNO3+NO ③2F2+2H2O=4HF+O2 ④2Na+2H2O=2NaOH+H2↑ ⑤Na2O+2HCl=2NaC1+H2O ⑥Cl2+2NaOH=NaCl+NaClO+H2O (1)上述反应中,不属于氧化还原反应的是_____________(填序号,下同)。 H2O被氧化的是_________;H2O被还原的是_________; 属于氧化还原反应,但反应物中的H2O既不被氧化又不被还原的是_________。 (2)用双线桥法标出反应②中电子转移的方向和数目:__________________________________________。 (3)用单线桥法标出反应③中电子转移的方向和数目:__________________________________________。 (4)写出反应⑥的离子反应方程式:__________________________________________。 |
|
| 22. 填空题 | 详细信息 |
某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了下图的实验装置。B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置。 (1)写出装置A中发生反应的化学方程式_______________________________________________。 (2)C中盛有____________,目的是___________________________________________________。 (3)写出装置D中发生反应的化学方程式_______________________________________________。 (4)指出装置E的错误___________________________________。 (5)写出过氧化钠与水反应的离子反应方程式___________________________________________。 |
|
高中化学 试卷推荐
- 高中化学人教版 必修1 第三章 金属及其化合物 3.用途广泛的金属材料 用途广泛的金属材料
- 2017-2018年高一上学期期中考试化学考试题(湖南省衡阳县四中)
- 2017-2018年高一上学期第二次月考化学考卷带参考答案和解析(贵州省遵义市第四中学)
- 2017-2018年高二12月月考化学试卷(山东省寿光市第一中学)
- 2018年至2019年高二上学期第一次月考化学试卷带参考答案和解析(宁夏回族自治区育才中学)
- 2017-2018年高一12月月考化学试卷(江苏省泰州中学)
- 高中化学人教版 选修三 第2章 分子结构与性质 键参数--键能、键长与键角
- 邻水实验学校高一化学月考测验(2019年上期)免费试卷完整版
最近更新



