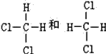2017高一下学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
1下列说法正确的是 A. 元素周期表有7个周期、18个族 B. 天然气是一种清洁的化石燃料 C. 工业上常用电解NaCl溶液的方法制取金属钠 D. 石油的分馏产物很多,属于化学变化
|
|
| 2. | 详细信息 |
|
下列化学用语正确的是 A. H2O的电子式: C. 乙醇的球棍模型:
|
|
| 3. | 详细信息 |
|
下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是 A. 氯气 二氧化碳 氢氧化钠 B. 氯化钠 过氧化钠 氯化铵 C. 氯化钠 过氧化氢 氯化铵 D. 氯化钠 氦气 氢氧化钠
|
|
| 4. | 详细信息 |
|
如图是周期表中短周期的一部分,下列叙述正确的是
A. 最高价氧化物对应水化物的酸性:F>O B. F2单质是氧化性最强的非金属单质 C. O的氢化物中不可能含有非极性共价键 D. N位于第二周期ⅪA族
|
|
| 5. | 详细信息 |
|
设NA为阿伏加德罗常数的数值,下列说法正确的是 A. 常温常压下,8gCH4含有2NA个碳氢键 B. 1mol Na与足量乙醇完全反应,失去2NA个电子 C. 1L 0.1mol•L﹣1的醋酸溶液中含有0.1NA个H+ D. 标准状况下,22.4L苯含有约NA个苯分子
|
|
| 6. | 详细信息 |
|
下列有关化学与自然资源的开发利用说法中不正确的是 A. 海水提镁的过程为:MgCl2(aq) B. 铝热反应实验中,需要用到的试剂有镁条、氯酸钾、铝粉和铁的氧化物 C. 电解法制备铝的化学方程式为:2Al2O3 D. 金属铜的制备一般用热还原法:H2 + CuO
|
|
| 7. | 详细信息 |
|
在四种不同情况下,可逆反应A(g)+2B(g)⇌C(g)+D(g)的反应速率如下,其中反应进行得最快的是 A. v(A)=0.15 mol/(L·min) B. v(B)=0.6 mol/(L·min) C. v(C)=0.4 mol/(L·min) D. v(D)=0.02 mol/(L·s)
|
|
| 8. | 详细信息 |
|
区别下列各组中的两种物质的方法错误的是 A. 甲烷和乙烯:分别通入酸性KMnO4溶液 B. 苯和四氯化碳:分别与溴水混合、振荡、静置 C. 乙醇和乙酸:分别滴加NaOH溶液 D. 棉花织品和羊毛织品:分别燃烧闻气味
|
|
| 9. | 详细信息 | |||||||||||||||
|
下列选项中能发生化学反应,且甲组为取代反应、乙组为加成反应的是
A. A B. B C. C D. D
|
||||||||||||||||
| 10. | 详细信息 |
|
把a、b、c三块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时b为负极;a、c相连时a极上产生大量气泡; c、b相连时,电流b由到c.则这三种金属的活动性顺序由大到小为 A. a>c>b B. a>b>c C. c>b>a D. b>c>a
|
|
| 11. | 详细信息 |
|
括号内物质为杂质,下列除去杂质的方法不正确的是 A. 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液 B. 乙烷(乙烯):用溴水洗气 C. 溴苯(溴):用NaOH溶液洗涤后分液 D. 乙醇(水):用生石灰吸水后蒸馏
|
|
| 12. | 详细信息 |
|
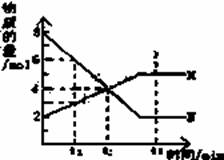
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A. 反应的化学方程式为:2N⇌M B. t2时,正逆反应速率相等,达到平衡 C. t1时,N的浓度是M的浓度的3倍 D. t3时,正反应速率大于逆反应速率
|
|
| 13. | 详细信息 |
|
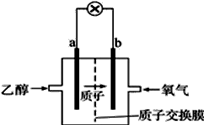
圣路易斯大学研制的新型乙醇燃料电池,用能传递质子(H+)的介质作溶剂,反应为C2H5OH+3O2→2CO2+3H2O,如图是该电池的示意图,下列说法正确的是
A. a极为电池的正极 B. 电池正极的电极反应为:4H++O2+4e﹣═2H2O C. 电池工作时电流由a极沿导线经灯泡再到b极 D. 电池工作时,1mol乙醇被氧化时就有6 mol电子转移
|
|
| 14. | 详细信息 |
|
下列与有机物的结构、性质有关的叙述正确的是 A. 分子式为C5H12的有机物有4种 B. 1mol苯分子中有3mol碳碳双键 C. 苯、乙醇、油脂均不能使酸性KMnO4溶液褪色 D. C3H2Cl6有4种同分异构体
|
|
| 15. | 详细信息 | ||||||||||||||||||||||||||||||||||||||||
|
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是
A. A B. B C. C D. D
|
|||||||||||||||||||||||||||||||||||||||||
| 16. | 详细信息 |
|
可逆反应2NO2(g) ①单位时间内生成n molO2的同时生成2n mol NO ②单位时间内生成n molO2的同时生成2n mol NO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态. A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
|
|
| 17. | 详细信息 |
|
(1)①16O和18O ②红磷和白磷 ③CH3CH2CH2CH3和CH3CH(CH3)2 ④ (a)属于同素异形体的是___________(填序号,下同) (b)属于同分异构体的是___________ (2)右图是测定中和热的装置,该装置中仪器A的名称是____________________ (3)右图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________(填化学式),b点代表的物质的电子式___________ (4)所有的氧化还原反应在理论上都能设计成一个原电池,以反应Cu+2Fe3+ =Cu2++2Fe2+为例设计一个简单原电池:该原电池正极反应为:_______________________; 负极材料:__________
|
|
| 18. | 详细信息 | ||||||||||||||||||||
|
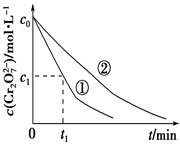
某酸性工业废水中含有K2Cr2O7 ,光照下,草酸(H2C2O4)能将其中的Cr2O转化为Cr3+。某课题组为进一步研究有关因素对该反应速率的影响,探究如下: (1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表。
测得实验①和②溶液中的Cr2O浓度随时间变化关系如图所示。 (2)上述反应后草酸被氧化为____________________(填化学式); (3)实验①和②的结果表明_______________________________; (4)实验①中0~t1时间段反应速率v(Cr3+)=___________________mol·L-1·min-1(用代数式表示)。
|
|||||||||||||||||||||
| 19. | 详细信息 |
|
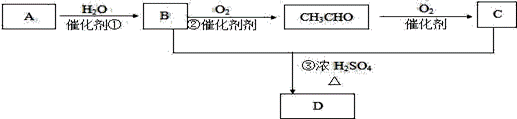
已知A的产量是衡量一个国家石油化工发展水平标志,下图是以A为原料生产某些化工产品的转化关系图.
据此回答下列问题. (1)写出A的结构简式_________________.D中官能团的名称________________ (2)反应①的反应类型___________________ (3)写出反应③的方程式的______________________________________________________ (4)写出C的属于酯类的同分异构体的结构简式_____________________
|
|
| 20. | 详细信息 |
|
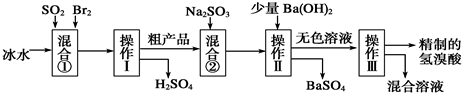
氢溴酸在医药和石化工业上有广泛用途。如图所示是模拟工业制备氢溴酸粗产品并精制的流程:
根据上述流程回答下列问题: (1)操作Ⅱ的名称是_______________; (2)混合①中发生反应的离子方程式为____________________________________________; (3)操作Ⅲ一般适用于分离____________混合物(填序号)。 a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体 (4)混合②中加入Na2SO3的目的是____________________________________________; (5)纯净的氢溴酸为无色液体,但实际工业生产中制得的氢溴酸带有淡淡的黄色。甲同学认为工业氢溴酸呈淡黄色是因为其中含有Fe3+,验证甲同学假设所用的试剂是________________;若其中含有Fe3+ ,现象是______________________。
|
|
| 21. | 详细信息 |
|
(1)化学反应 N2(g)+
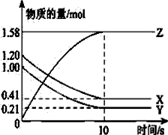
该反应放出的热量为__________________________________(用代数式表示) (2)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数为____________。 (3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、稀硫酸构成,该电池工作时,(工作原理: Pb + PbO2 + 2H2SO4 === 2PbSO4 + 2H2O),若电路中转移2mol电子,则负极材料质量的变化量为_________g. (4)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:该反应中X的平衡转化率为__________
|
|