2016高一下学期人教版高中化学期中考试
| 1. | 详细信息 |
|
下列各组中两种微粒所含电子数不相等的是 A.S2-和Al3+ B.CO和N2 C.H3O+和OH- D.NH3和NH4+
|
|
| 2. | 详细信息 |
|
一种铂(Pt)原子的质量数是196,质子数比中子数少40。该原子的核素符号是 A.
|
|
| 3. | 详细信息 |
|
下列说法错误的是 A.氢是原子半径最小的元素 B.氟是非金属性最强的元素 C.硅元素适合作半导体材料 D.稀有气体元素原子的最外层电子数均为8
|
|
| 4. | 详细信息 |
|
设NA为阿伏加德罗常数值。下列有关叙述正确的是 A.1 mol D2O分子所含的中子数为8NA B.48 g氧气和臭氧的混合气体中的氧原子数为3NA C.11.2 L 甲烷(CH4)中的共价键数为2NA D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
|
|
| 5. | 详细信息 |
|
下列对于铍元素及其化合物的性质的推断正确的是 A.铍原子的半径大于硼原子的半径 B.相同条件下, C.氢氧化铍的碱性比氢氧化钙的碱性强 D.单质铍能与冷水剧烈反应
|
|
| 6. | 详细信息 |
|
下列物质中,有非极性共价键的是 A.氨 B.二氧化碳 C.过氧化钠 D.次氯酸
|
|
| 7. | 详细信息 |
|
下列有关化学用语表示正确的是 A.Mg原子的结构示意图 B.OCl2分子的电子式 C.HF分子的电子式 D.Na2S形成的电子式
|
|
| 8. | 详细信息 |
|
下列说法错误的是 A.燃料的燃烧反应都是放热反应 B.一定量的燃料完全燃烧 C.放热反应的逆反应一定是吸热反应 D.加热能发生的反应是吸热反应
|
|
| 9. | 详细信息 |
|
一定条件下,某容器中各微粒在反应前后变化的示意图如下:(其中●代表氧原子,○代表硫原子)
反应前 反应后 关于此反应说法错误的是 A.一定属于分解反应 B.一定属于氧化还原反应 C.一定属于放热反应 D.一定属于可逆反应
|
|
| 10. | 详细信息 |
|
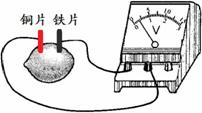
如果用铁片和铜片构成柠檬电池,会发生的是
柠檬电池 A.铜片上发生反应:Cu - 2e- ═ Cu2+ B.铁片是负极,其质量逐渐减小 C.电流由铁片经导线流向铜片 D.柠檬中蕴含的电能转化为化学能
|
|
| 11. | 详细信息 |
|
下列与化学反应速率的 A.建筑中使用的铝合金门窗比钢门窗更耐腐蚀 B.窗帘上直接受阳光照射的一面布料容易褪色 C.肉放在冷冻箱中要比放在保鲜箱中存放的时间更长久 D.实验室用硫酸溶液与锌粒反应制取氢气,反应一段
|
|
| 12. | 详细信息 |
|
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,断裂1mol H2中的化学键消耗的能量为Q1 kJ,断裂1mol Cl2中的化学键消耗的能量为Q2 kJ,形成1mol HCl中的化学键释放出的能量为Q3 kJ。下列关系式中正确的是 A.Q1 + Q2﹤Q3 B.Q1 + Q2﹤2Q3 C.Q1 + Q2﹥Q3 D.Q1 + Q2﹥2Q3
|
|
| 13. | 详细信息 |
|
元素周期律表明 A.随着原子序数的增大,元素的主要化合价逐渐增加 B.随着随着相对原子质量的增大,元素的化学性质会不断重复 C.与碱金属相比,其相邻主族的(碱土)金属具有更小的密度和硬度 D.卤素氢化物的稳定性随着核电荷数的增加而减弱
|
|
| 14. | 详细信息 |
|
X、Y、Z、W是原子序数依次增大的短周期元素,它们的最外层电子数分别为1、1、6、7。X-的电子层结构与氦相同,Y、Z和W的次外层有8个电子。下列叙述错误的是 A.元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6 B.原子半径的大小为Y﹥Z﹥W C.元素的非金属性顺序为W﹥Z﹥X D.Y和其他3种元素均能形成离子化合物
|
|
| 15. | 详细信息 |
|
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体)。在100 kPa时,1mol石墨转化为金刚石,要吸收1.895 kJ的热能。试判断在100 kPa时,下列结论正确的是 A.金刚石比石墨稳定 B.1mol石墨比1mol金刚石的总能量高 C.若在等量氧气中充分燃烧,1mol金刚石比1mol石墨的释放的能量高 D.仅提供1.895 kJ的热能,工业上就能将1mol石墨转化为金刚石
|
|
| 16. | 详细信息 |
|
现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生,Y溶解;②把Z、W用导线连接后同时浸入稀硫酸溶液中,W发生还原反应;③把X、Z用导线连接后同时浸入稀硫酸溶液中 A.在①中金属片Y发生还原反应 B.在②中金属片W作负极 C.上述四种金属的活动性顺序为W﹤X﹤Z﹤Y D.如果把Y、W用导线相连后同时浸入稀硫酸溶液,则电子流动方向为Y→导线→W
|
|
| 17. | 详细信息 |
|
已知X、Y、Z、W是短周期中原子序数依次增大的4种主族元素。X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;元素Y 的原子最外层电子数是其内层的3倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W的单质常温常压下为气态。 回答下列问题: (1)元素W在周期表中位于第 ▲ 周期,第 ▲ 族。 (2)从空气中获得的X元素单质的电子式: ▲ 。 (3)比较Y与Z形成的简单(单原子)离子的半径相对大小: ▲ ﹤ ▲ (用离子符号表示)。 (4)管道工人曾经用X的氢化物检验W单质是否泄漏。W单质能将X从其气态氢化物中置换出来。试写出该反应的化学方程式: ▲ ;W单质泄漏时出现的现象是 ▲ 。
|
|
| 18. | 详细信息 | |||||||||||||||
|
为探究元素性质递变规律,设计如下实验。 (1)填写各实验步骤对应的实验现象(选填相应序号;不重复选)。
A.剧烈反应,迅速产生大量无色气体。 B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 C.反应不十分剧烈;产生无色气体。 D.有气体产生,溶液变成浅红色。 (2)实验④:向1mL 1 mol/L AlCl3溶液中滴加2 mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失。 请用离子方程式解释该实验现象: ▲ 、 ▲ 。 (3)实验⑤:在试管中加入3~5 mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡。观察试管中出现白色凝胶。相应化学方程式: ▲ ,证明酸性: ▲ (4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水。观察试管中出现黄色沉淀。相应离子方程式: ▲ ,证 通过以上实验和讨论,推断钠、镁、铝的金属性逐渐 ▲ (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐 ▲ (选填“增强”或“减弱”)。
|
||||||||||||||||
| 19. | 详细信息 | ||||||||||||||||||||||||||||||||||||
|
某化学反应2A
根据上述数据,回答下列问题 : (1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为 ▲ 。 (2)在实验1中,c1数值为 ▲ 。 (3)在实验1、2中有一个实验使用了正催化剂。判断是实验 ▲ (选填“1”或“2”)使用了正催化剂。 (4)在实验1、3中反应温度不同。判断T3 ▲ 800(选填“﹤”或“﹥”)。
|
|||||||||||||||||||||||||||||||||||||
| 20. | 详细信息 |
|
“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。” Ⅰ.体验H2O2分解的实验意义 (1)指出本实验的探究目的: ▲ 。 (2)写出H2O2分解反应方程式并标出电子转移的方向和数目: ▲ 。 (3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ▲ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。 Ⅱ.探讨FeCl3催化H2O2分解的机理 (4)Fe3+催化H2O2分解时涉及2步反应: 第1步,Fe3+ 氧化H2O2 :2 Fe3+ + H2O2 ═ 2 Fe2+ + O2 ↑+2 H+ 第2步,H2O2 氧化Fe2+ : ▲ (用离子方程式表示)
|
|
| 21. | 详细信息 |
|
C、CH4是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量分别为393.5 kJ、890.3 kJ。计算说明:(写出必要的文字说明和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,数值结果保留到小数点后1位。) (1)1 g C完全燃烧时放出的热量。 ▲ (2)完全燃烧相同质量的C和CH4,哪种燃料放出热量较多? ▲
|
|