2019江苏高一下学期苏教版高中化学期中考试
| 1. | 详细信息 |
|
化学与科学、社会和人类生活密不可分,修订后的《中华人民共和国大气污染防治法》已于2016年1月1日起施行。下列有关大气污染防治说法错误的是 A.开发新能源,如太阳能、风能等,减少对化石能源的依赖,也减少对大气的污染 B.农作物收割后留下的秸秆可以就地焚烧 C.实施“煤改气”、“煤改电”等清洁燃料改造工程,有利于保护环境 D.汽油发动机工作时会产生少量NO和CO,采用催化反应装置可以减少污染物排放
|
|
| 2. | 详细信息 |
|
下列化学用语表示正确的是
C.
|
|
| 3. | 详细信息 |
|
下列变化中,吸收的热量用于克服分子间作用力的是 A.液溴受热变成溴蒸气 B.加热金刚石使之熔化 C.加热食盐使之熔化 D.加热碘化氢使之分解
|
|
| 4. | 详细信息 |
|
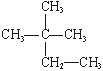
下列过程只涉及物理变化的是 A.伐薪烧炭 B.酿酒成醋 C.滴水成冰 D.百炼成钢
|
|
| 5. | 详细信息 |
|
下列物质属于共价化合物的是 A.CaO B.CO2 C.K2O D.NaCl
|
|
| 6. | 详细信息 |
|
在含有大量的Na+、OH—、NO3—,该溶液中还可能大量存在的离子是 A.NH4+ B. H+ C. SO42— D.Mg2+
|
|
| 7. | 详细信息 |
|
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于氯离子的半 径。X元素为 A.Al B.P C.S D.K
|
|
| 8. | 详细信息 |
|
从某微粒的原子结构示意图反映出 A.质子数和中子数 B.中子数和电子数 C.核电荷数和核外电子层排布的电子数 D.质量数和核外电子层排布的电子数
|
|
| 9. | 详细信息 |
|
实验室制备硅酸的反应为Na2SiO3+2HCl=2NaCl+H2SiO3↓,该反应属于 A.化合反应 B.分解反应 C.置换反应 D.复分解反应
|
|
| 10. | 详细信息 |
|
依据元素周期表及元素周期律,下列推断正确的是 A.同周期主族元素的原子形成的简单离子电子层结构相同 B.C比Si的原子半径小,CH4的稳定性比SiH4弱 C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料
|
|
| 11. | 详细信息 |
|
下列各组顺序排列不正确的是 A.热稳定性:HCl>H2S>PH3 B.原子半径:Na<Mg<Al C.酸性强弱:H2SiO3<H3PO4<H2SO4 D.碱性强弱:NaOH>Mg(OH)2>Al(OH)3
|
|
| 12. | 详细信息 |
|
中国最新战机歼-31使用了高强度、耐高温的钛合金材料。工业上冶炼钛的反应如下:
A.TiCl4是还原剂 B.Mg被氧化 C.TiCl4发生氧化反应 D.Mg得到电子
|
|
| 13. | 详细信息 |
|
已知A的原子序数是x,B2-与A3+具有相同的电子层结构,则B元素的原子序数为 A x+5 B x-5 C x+1 D x-1
|
|
| 14. | 详细信息 |
|
X、Y、Z是三种短周期的元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是 A.N、O、S B.P、S、O C.O、F、Cl D.C、Si、P
|
|
| 15. | 详细信息 |
|
在常温常压下,下列各组气体不能共存的是 A.SO2与O2 B.NO2与NO C.O2与N2 D.NO与O2
|
|
| 16. | 详细信息 |
|
起固氮作用的化学反应的是 A.工业上用氮气和氢气合成氨气 B.一氧化氮与氧气反应生成二氧化氮 C.氨气经催化氧化生成一氧化氮 D.由氨气制碳酸氢氨和硫酸氨
|
|
| 17. | 详细信息 |
|
在NO2与水的反应中,水 A.是还原剂 B.是氧化剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
|
|
| 18. | 详细信息 |
|
限用一种试剂, 经过一次性实验就能鉴别下列四种溶液:Na2CO3、(NH4)2SO4、NH4Cl、KNO3, 应选用 A. AgNO3溶液 B. NaOH溶液 C. Ba(OH)2溶液 D. 盐酸
|
|
| 19. | 详细信息 |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为14。X是元素周期表中原子半径最小的元素,Z与X原子的最外层电子数相同,Y与W同主族。下列说法正确的是 A.X与Y只能形成一种化合物 B.原子半径:r(Y)<r(W)<r(Z) C.W的简单气态氢化物的热稳定性比Y的强 D.Z的最高价氧化物对应的水化物是酸
|
|
| 20. | 详细信息 |
|
通入水中所得溶液呈碱性的气体是 A.NH3 B.NO2 C.SO2 D.HCl
|
|
| 21. | 详细信息 |
|
下列关于化学键的叙述,正确的是 A.离子化合物中一定含有离子键 B.单质分子中均不存在化学键 C. 含有共价键的化合物一定是分子晶体 D.含有共价键的化合物一定是共价化合物
|
|
| 22. | 详细信息 |
|
某主族元素的最高价含氧酸的阴离子是RO3-,则该元素的气态氢化物的化学式是 A.HR B.H2R C.RH3 D.RH4
|
|
| 23. | 详细信息 |
|
向800 mL稀硝酸中加入一定质量的铁粉,铁粉完全溶解后,放出NO气体11.2 L(标准状况),同时溶液质量增加18.6 g。下列判断正确的是: A. 反应后的溶液中c(Fe2+)∶c(Fe3+)=1∶1 B. 原溶液中投入铁粉物质的量是0.5 mol C. 原溶液中HNO3的浓度是2.0 mol·L-1 D. 反应后的溶液中还可溶解16.0 g铜
|
|
| 24. | 详细信息 |
|
根据要求回答下列问题:
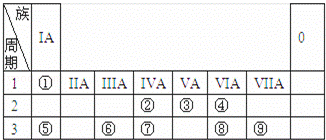
⑤ 这八种物质中,④的结构式是 ▲ ,⑦的中子数是 ▲ ;互为同位素的是 ▲ (填序号) (2)在①CaCl2、②KOH、③He、④H2SO4、⑤Na2O2、⑥I2、⑦金刚石, 不含化学键的是 ▲ , 既含有离子键又含有共价键的 ▲ ;属于共价化合物的是 ▲ ;(都填序号) (3)写出下列物质的电子式: NaOH ▲ NH3 ▲ (4).如下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
i.画出⑦的原子结构示意图 ▲ ; ii.②⑤⑥的原子半径由大到小的顺序为 ▲ (填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是 ▲ (填化学式); iii.②的单质与③的最高价氧化物对应水化物的浓溶液能发生反应,写出其中反应的化学方程式 ▲ ; ix.写出⑥的单质与⑤的最高价氧化物对应水化物溶液反应化学方程式 ▲ ;
|
|
| 25. | 详细信息 |
|
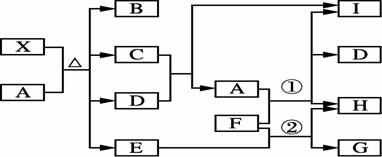
有关物质的转化关系如下图所示,A是一种常见强酸,固体X是一种含铁的化合物,由两种常见元素组成,一种为非金属元素,且质量比为14∶1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色。
请回答下列问题: (1) D的电子式为____________。 (2) X的化学式为____________。 (3) 写出反应①的化学方程式:____________。 (4) 写出反应②的离子方程式:____________。
|
|
| 26. | 详细信息 |
|
将38.4克铜投入到100ml一定浓度的浓硝酸中,两者恰好完全反应,产生气体为NO和NO2,标准状况下混合体积为11.2L,求 (1)混合气体中NO的体积(标准状况下) (2)原硝酸的物质的量浓度 (3)若将产生的气体全部通入足量的水中,最后剩余的气体体积为多少(标准状况下)?
|
|