揭西县河婆中学高一化学期中考试(2019年上册)在线免费考试
| 1. 选择题 | 详细信息 |
|
下列有关实验的选项正确的是( ) A. 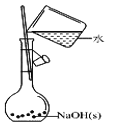 配制0.10mol/LNaOH溶液 配制0.10mol/LNaOH溶液B. 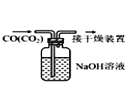 除去CO中的CO2 除去CO中的CO2C. 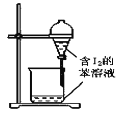 苯萃取碘水中的I2,分出水层后的操作 苯萃取碘水中的I2,分出水层后的操作D. 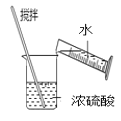 稀释浓硫酸 稀释浓硫酸 |
|
| 2. 选择题 | 详细信息 |
|
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( ) A. 萃取 B. 渗析 C. 蒸馏 D. 干馏 |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是 ( ) A. 将饱和FeCl3溶液逐滴加入NaOH溶液中可制得Fe(OH)3胶体 B. 雾属于分散系中的胶体,它的分散剂是水蒸气 C. 胶体区别于其它分散系的本质特征是丁达尔效应 D. 向Fe(OH)3胶体中逐滴加入稀硫酸至过量,先生成红褐色沉淀最后沉淀溶解 |
|
| 4. 选择题 | 详细信息 |
|
下列关于胶体的叙述中不正确的是( ) A. 可利用丁达尔效应区分胶体与溶液 B. 将盐卤或石膏加入豆浆中,制成豆腐,利用了胶体聚沉的性质 C. 氯化铁溶液与氢氧化铁胶体都能透过半透膜 D. 胶体粒子有较大的表面积,能吸附阳离子或阴离子,在电场作用下产生电泳现象 |
|
| 5. 选择题 | 详细信息 |
|
用NA表示阿伏德罗常数,下列叙述正确的是 ( ) A. 标准状况下,22.4LH2O含有的分子数为1 NA B. 常温常压下,16g O2含有的原子数为1 NA C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA |
|
| 6. 选择题 | 详细信息 |
|
在下列状态下,属于能够导电的电解质是( ) A. 氯化钠晶体 B. 液态氯化氢 C. 硝酸钾溶液 D. 熔融氢氧化钠 |
|
| 7. 选择题 | 详细信息 |
|
某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2CO3溶液,②NaOH溶液, ③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是 A. ②③① B. ③②① C. ①②③ D. ③①② |
|
| 8. 选择题 | 详细信息 |
|
能在无色溶液中大量共存的一组离子是 ( ) A. Mg2+、SO42-、OH-、K+ B. Fe3+、NO3-、Cl-、H+ C. K+、HCO3-、Cl-、H+ D. H+、Na+、Cl-、SO42- |
|
| 9. 选择题 | 详细信息 |
|
下列离子方程式书写不正确的是( ) A. 向稀硫酸中加入氢氧化钡溶液中:Ba2+ + OH— + H+ + SO42—=BaSO4↓+H2O B. 碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ C. 金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑ D. 向小苏打溶液中加入盐酸溶液:HCO3—+H+=CO2↑+H2O |
|
| 10. 选择题 | 详细信息 | ||||||||||||||||||||
除去下列物质中的杂质(括号内为杂质),所选用试剂及操作方法均正确的是( )
|
|||||||||||||||||||||
| 11. 选择题 | 详细信息 |
|
已知M2O7x- + 3 S2- + 14 H+ = 2 M 3+ + 3S ↓ + 7H2O,则M2O7x-中的M的化合价为( ) A. +2 B. +3 C. +4 D. +6 |
|
| 12. 选择题 | 详细信息 |
|
运动会发令枪击发时发生的反应时5KClO3 + 6P = 3P2O5 + 5KCl。关于该反应说法正确的是( ) A. 反应中P得到电子 B. 消耗1mol KClO3时,转移5mol电子 C. 氧化剂与还原剂的物质的量比为5:3 D. 发令时看到白烟可能是P2O5固体颗粒 |
|
| 13. 选择题 | 详细信息 |
|
有如下两个反应:(1)Cu+2Fe3+=Cu2++2Fe2+(2)Fe+Cu2+=Fe2++Cu。判断Fe3+、Fe2+、Cu2+氧化性强弱顺序排列正确的是 A. Fe3+>Cu2+>Fe2+ B. Cu2+>Fe3+>Fe2+ C. Fe3+Fe2+>Cu2+ D. Fe2+>Cu2+>Fe3+ |
|
| 14. 填空题 | 详细信息 |
蒸馏是实验室制备蒸馏水的常用方法,如图所示两个装置都可以制取蒸馏水。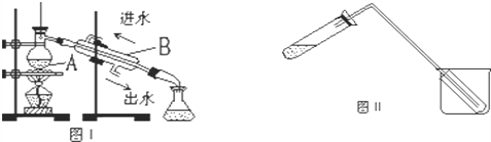 (1)图Ⅰ是实验室制取蒸馏水的常用装置,仪器A、B的名称分别是: A_________、B___________ (2)温度计水银球应置于_________________________ (3)实验时A 中除加入一定量的自来水外,还需加入少量________,其作用是___________。 (4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长。其作用是________________________。 |
|
| 15. 解答题 | 详细信息 |
|
按要求回答下列问题 (1)①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气 ⑦蔗糖 ⑧二氧化碳⑨液态氯化氢 ⑩硫酸溶液。上述物质中能导电的是____,属于电解质的是_____,属于非电解质的是_____。(填编号) (2)按要求写出下列方程式 ①KAl(SO4)2电离的电离方程式:____________ ②碳酸钙与盐酸反应的离子方程式:_________ |
|
| 16. 计算题 | 详细信息 |
|
(1)3.01×1023个NH4+含有质子的物质的量是____ ,含有电子的物质的量是_____; (2)200mL 2mol/L的Al2(SO4)3溶液中SO42﹣的物质的量浓度为_____ ; (3)标准状况下,36g H2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为______; (4)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为____; (5)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是______。 |
|
| 17. 填空题 | 详细信息 |
|
现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制480mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题: (1)上述仪器中,在配制稀硫酸时不需要用到的是___________(填序号) (2)配制过程中需选用的容量瓶规格为___________ mL,经过计算,需要浓硫酸的体积为_______。 (3)在配制过程中,下列操作错误的是____________,能使所配溶液浓度偏高的是___________(填序号) ①洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中 ②为防止变质,稀释后的硫酸溶液应立即就转移到容量瓶中 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④移液前,容量瓶中含有少量蒸馏水 ⑤量取浓硫酸时,俯视刻度线 |
|
| 18. 实验题 | 详细信息 |
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图: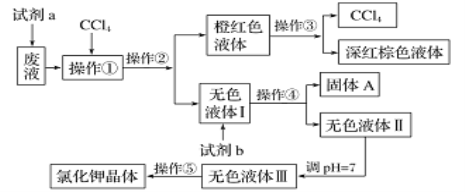 已知:可供选择的试剂 a、试剂b(试剂 b代表一组试剂)如下:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液(H+)、KMnO4溶液(H+)、稀盐酸。请根据流程图,回答相关问题: (1)若试剂a为H2O2溶液(H+),已知H2O2 + 2KBr + 2HCl = Br2 + 2H2O + 2KCl ①发生反应的离子方程式为:__________; ②每消耗0.2molH2O2,反应转移的电子数为______mol; ③还原剂和还原产物的物质的量之比是_______; (2)操作①②③④⑤对应的名称分别是:______、分液、_____、过滤、______ ; (3)为了除去无色液体I中的Ca2+、Mg2+、SO42-,从可供选择的试剂中选出试剂b所代表的物质,按滴加顺序依次是____、____、____(填化学式); (4)调pH=7是为了除去杂质离子________和_________,以提高氯化钾晶体的纯度; (5)操作⑤中用到的瓷质仪器名称是_________ 。 |
|
| 19. 综合题 | 详细信息 |
|
实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为: 2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O (1)请将上述化学方程式改写为离子方程式________________。 (2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。 ①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性 (3)此反应中氧化产物是_________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为______mol。 (4) 用双线桥法表示该反应的电子转移的方向和数目 _____ 2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O |
|
最近更新



